Как получить водород?
Содержание:
Физические свойства

Водород является легчайшим из всех известных науке веществ (он в 14,4 раз легче воздуха), его плотность составляет 0,0899 г/л (1 атм, 0 °С). Данный материал плавится (затвердевает) и кипит (сжижается), соответственно, при -259,1 °С и -252,8 °С (только гелий обладает более низкими t° кипения и плавления).
Критическая температура водорода крайне низка (-240 °С). По этой причине его сжижение — довольно сложный и затратный процесс. Критическое давление вещества — 12,8 кгс/см², а критическая плотность составляет 0,0312 г/см³. Среди всех газов водород имеет наибольшую теплопроводность: при 1 атм и 0 °С она равняется 0,174 вт/(мхК).
Удельная теплоемкость вещества в тех же условиях — 14,208 кДж/(кгхК) или 3,394 кал/(гх°С). Данный элемент слабо растворим в воде (около 0,0182 мл/г при 1 атм и 20 °С), но хорошо — в большинстве металлов (Ni, Pt, Pa и прочих), особенно в палладии (примерно 850 объемов на один объем Pd).
С последним свойством связана его способность диффундирования, при этом диффузия через углеродистый сплав (к примеру, сталь) может сопровождаться разрушением сплава из-за взаимодействия водорода с углеродом (этот процесс называется декарбонизация). В жидком состоянии вещество очень легкое (плотность — 0,0708 г/см³ при t° = -253 °С) и текучее (вязкость — 13,8 спуаз в тех же условиях).
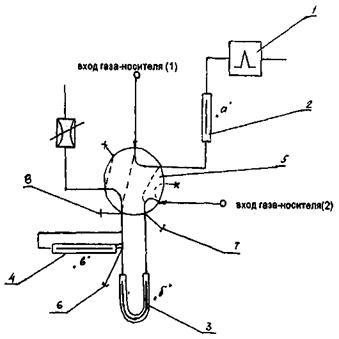
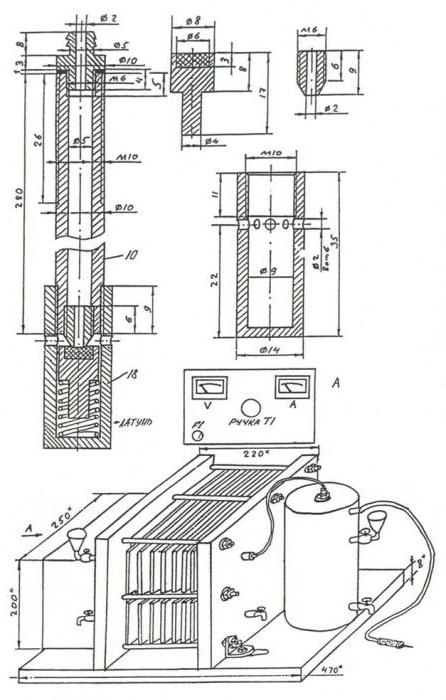
Изготовление электролизера своими руками
 Электролизер своими руками
Электролизер своими руками
Цены на дорогое зарубежное оборудование часто отпугивают простых владельцев небольших хозяйств. Однажды обжёгшись а недорогом электролизере не очень высокого качества или и вовсе решив не рисковать, умельцы задумываются о самостоятельном изготовлении домашнего генератора водорода. В целом, задача выполнимая, при условии владения определенными знаниями и умениями.
Для того, чтобы сделать собственный электролизер, понадобится приобрести и все составляющие установки, которые были перечислены выше. Кроме того, процесс не заканчивается на этапе выделения топлива. Ведь ещё нужно отделить водород от кислорода и водяного пара, обеспечить его постоянный ток, накопление в нужном объеме и подачу. В результате конечный подсчёт покажет, что самостоятельная сборка обойдётся не на много дешевле покупного генератора, а вот сил и времени уйдёт неимоверное количество. И неизвестно, будет ли полученный результат соответствовать ожиданиям и справляться с поставленной задачей.
Получение
Основная статья: Производство водорода
См. также: Биотехнологическое получение водорода
В промышленности
Конверсия с водяным паром при 1000 °C:
-
- CH4+H2O ⇄ CO+3H2{\displaystyle {\mathsf {CH_{4}+H_{2}O\ \rightleftarrows {}\ CO+3H_{2}}}}
Пропускание паров воды над раскалённым коксом при температуре около 1000 °C:
-
- H2O+C ⇄ CO↑+H2↑{\displaystyle {\mathsf {H_{2}O+C\ \rightleftarrows {}\ CO\uparrow +H_{2}\uparrow }}}
Электролиз водных растворов солей:
-
- 2NaCl+2H2O → 2NaOH+Cl2↑+H2↑{\displaystyle {\mathsf {2NaCl+2H_{2}O\ {\xrightarrow {}}\ 2NaOH+Cl_{2}\uparrow +H_{2}\uparrow }}}
Электролиз водных растворов гидроксидов активных металлов (преимущественно, гидроксида калия) (англ.)
-
- 2H2O→4e−2H2↑+O2↑{\displaystyle {\ce {2H2O -> 2H2 ^ + O2 ^}}}
- Кроме того, существует промышленная технология электролиза химически чистой воды, без применения каких-либо добавок. Фактически, устройство представляет собой обратимый топливный элемент с твердой полимерной мембраной (англ.).
Каталитическое окисление кислородом:
-
- 2CH4+O2⇄ 2CO+4H2{\displaystyle {\mathsf {2CH_{4}+O_{2}\rightleftarrows {}\ 2CO+4H_{2}}}}
Крекинг и риформинг углеводородов в процессе переработки нефти.
В лаборатории
Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную серную кислоту:
-
- Zn+H2SO4→ZnSO4+H2↑{\displaystyle {\mathsf {Zn+H_{2}SO_{4}\rightarrow ZnSO_{4}+H_{2}\uparrow }}}
Взаимодействие кальция с водой:
-
- Ca+2H2O→Ca(OH)2+H2↑{\displaystyle {\mathsf {Ca+2H_{2}O\rightarrow Ca(OH)_{2}+H_{2}\uparrow }}}
Гидролиз гидридов:
-
- NaH+H2O→NaOH+H2↑{\displaystyle {\mathsf {NaH+H_{2}O\rightarrow NaOH+H_{2}\uparrow }}}
Действие щелочей на цинк или алюминий:
-
- 2Al+2NaOH+6H2O→2NaAl(OH)4+3H2↑{\displaystyle {\mathsf {2Al+2NaOH+6H_{2}O\rightarrow 2Na+3H_{2}\uparrow }}}
-
- Zn+2KOH+2H2O→K2Zn(OH)4+H2↑{\displaystyle {\mathsf {Zn+2KOH+2H_{2}O\rightarrow K_{2}+H_{2}\uparrow }}}
С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
-
- 2H3O++2e−→2H2O+H2↑{\displaystyle {\mathsf {2H_{3}O^{+}+2e^{-}\rightarrow 2H_{2}O+H_{2}\uparrow }}}
Очистка
В промышленности реализованы несколько способов очистки водорода из углерод-содержащего сырья (т. н. водородсодержащий газ — ВСГ).
- Низкотемпературная конденсация: ВСГ охлаждают до температур конденсации метана и этана, после чего водород отделяют ректификацией. Процесс ведут при температуре −158 °C и давлении 4 МПа. Чистота очищенного водорода составляет 93—94 % при его концентрации в исходном ВСГ до 40 %.
- Адсорбционное выделение на цеолитах: Настоящий метод на сегодняшний день наиболее распространен в мире. Метод достаточно гибок и может использоваться как для выделения водорода из ВСГ, так и для доочистки уже очищенного водорода. В первом случае процесс ведут при давлениях 3,0—3,5 МПа. Степень извлечения водорода составляет 80-85 % с чистотой 99 %. Во втором случае часто используют процесс «PSA» фирмы «Union Carbide». Он впервые был реализован в промышленности в 1978 году. На настоящий момент функционирует более 250 установок от 0,6 до 3,0 млн м3 Н2/сут. Образуется водород высокой чистоты 99,99 %.
- Абсорбционное выделение жидкими растворителями: Этот метод применяется редко, хотя водород получается высокой чистоты 99,9 %.
- Концентрирование водорода на мембранах: На лучших образцах метод позволяет получать водород чистотой 95-96 %, однако производительность таких установок невысока.
- Селективное поглощение водорода металлами: Метод основан на способности сплавов лантана с никелем, железа с титаном, циркония с никелем и других поглощать до 30 объёмов водорода.
Получение чистого водорода
Водород можно получить различными способами. Вот лишь некоторые из них, являющиеся наиболее доступными и распространёнными:
- Электролиз воды. Наиболее эффективный способ — высокотемпературный.
- Химическая реакция воды и аллюминиево-галиевого сплава.
- Получение водорода при высокотемпературной обработке угля и древесины.
- Переработка мусора, бытовых отходов.
- Выделение водорода через переработку биомассы (навоза, сена, водорослей и иных отходов сельского хозяйства).
Большинство способов основаны на применении высоких температур и, к сожалению, в условиях обычного домашнего хозяйства неприменимы. Однако есть несколько путей для получения водорода в домашних условиях.
Электролизный водород
Самый доступный и наиболее широко распространённый способ добычи водорода в домашних условиях — при помощи реакции электролиза воды. Специальное оборудование, называемое электролизером, довольно доступно на рынке. При этом среди производителей встречаются как именитых гиганты (например, Honda), так и мелкие производители из Китая или стран СНГ. И если в случае с первыми в качестве предоставляемой вниманию продукции можно не сомневаться, то вот вторые часто подводят
При этом не стоит особо обращать внимание на их яркую и многообещающую рекламу. Недобросовестному производителю ничего не стоит заявить о том, что его продукт самый качественный, хороший и долговечный на рынке
Однако не всё, что он скажет, окажется правдой. Особенно должна настораживать цена, так как генератор не может быть слишком дешёвым. Дешевизна может указывать на не очень качественные материалы, использованные при работе, или экономию на сборке. Установки дорогие не просто так, а за счёт обеспечения безопасности в том числе. Так как водород является взрывоопасным, его утечка может принести много бед. Некачественные шланги, негерметичный накопительный бак — и всё, взрыв обеспечен. Качество исполнения иногда может «хромать», так что лучше однажды не поскупиться и потратиться на хорошее оборудование.
Хороший электролизер способен похвастаться качеством, компактностью и простотой эксплуатации. Его можно установить в любом уголке помещения и в качестве топлива для получения заветного водорода использовать обычную воду из-под крана. Обычно электролизер состоит из риформера, топливных элементов, очистной системы, компрессора и ёмкости для хранения газа. Электроэнергия поступает из сети питания. Самые современные модели и вовсе оснащены солнечными батареями. Такое оборудование точно быстро окупится за счет минимальных затрат на его использование, даже учитывая не самую маленькую стоимость самого агрегата.
Водород из сельскохозяйственных отходов
Нередко в интернете можно встретить упоминания о биогазовых установках. Смысл их работы сводится к тому, что в генератор загружается навоз, он там перерабатывается и на выходе получается метан. Конечно, может использоваться не только навоз, а любой компостируемый материал. Однако чистый навоз является наиболее продуктивным и доступным. Полученный биогаз затем по трубам поступает на нужды хозяйства и используется как привычный природный газ. Однако у этого способа добычи водорода есть пара минусов:
- Водород как таковой в данном процессе является лишь побочным продуктом. Для того,чтобы его отделить, требуется дополнительная обработка полученного газа. Как правило, никто этим не занимается и водород благополучно погибает в объятиях пламени вместе с метаном.
- Необходимо непрерывное поступление сырья. То есть в генератор без остановки должен поступать навоз, и в больших количествах. Очевидно, что обычное частное хозяйство не сможет обеспечить постоянный поток сырья. А покупать его на стороне — не выгодно. Вывод: такой метод получения водорода подходит только относительно крупным хозяйствам, готовым предоставлять такие объёмы. Однако им такая установка выгоды не принесёт, разве что позволит с пользой для хозяйства избавляться от отходов.
Кроме того, на долю водорода на выходе приходится всего лишь 2-12% водорода. То есть основная масса продукта — метан. Чтобы обеспечивать хозяйство именно водородом, потребуется неимоверное количество сырья и огромные производственные мощности. Так что даже крупным хозяйствам невыгодно фокусироваться именно на выделении водорода. Им придётся либо сжигать его вместе с метаном, что и делается на практике, либо пытаться использовать его также в хозяйстве. Однако для выделения и хранения водорода снова потребуется дополнительное оборудование, а значит, дополнительные расходы. Таким образом, биогазовая установка на сегодняшний день является самым невыгодным методом добычи чистого водорода.
Получение водорода в лаборатории
Современный лабораторный способ получения водорода не отличается от того, которым его получал Генри Кавендиш. Это реакции металлов с кислотами. В лаборатории водород получают в аппарате Киппа (рисунок 152).
Аппарат Киппа изготовляется из стекла и состоит из нескольких частей:
- реакционная колба с резервуаром;
- воронка с длинной трубкой;
- газоотводная трубка.
Реакционная колба имеет верхнюю шарообразную часть с отверстием, в которое вставляется газоотводная трубка, снабженная краном или зажимом, и нижний резервуар в виде полусферы. Нижний резервуар и реакционная колба разделены резиновой или пластиковой прокладкой с отверстием, через которое проходит в нижний резервуар длинная трубка воронки, доходящая почти до дна. На прокладку через боковое отверстие шпателем насыпают твёрдые вещества (мрамор, цинк). Отверстие закрывается пробкой с газоотводной трубкой. Затем при открытом кране или зажиме в верхнюю воронку заливается раствор кислоты. Когда уровень жидкости достигает вещества на прокладке, начинается химическая реакция с выделением газа. При закрытии крана давление выделяющегося газа выдавливает жидкость из реактора в верхнюю часть воронки. Реакция прекращается. Открытие крана приводит к возобновлению реакции. Поместим в реакционную колбу кусочки цинка. В качестве кислоты воспользуемся серной кислотой. При контакте цинка и серной кислоты протекает реакция:
Водородом можно заполнить мыльный пузырь.
Для этого необходимо опустить газоотводную трубку в мыльный раствор. На конце трубки начнется формирование мыльного пузыря, заполненного водородом; со временем пузырь отрывается и улетает вверх, что доказывает легкость водорода. Соберем выделяющийся водород. С учетом того, что водород намного легче воздуха, для сбора водорода сосуд, в котором собирается газ, необходимо располагать вверх дном, или производить собирание методом вытеснения воды. Как обнаружить водород? Заполним пробирку водородом, держа ее вверх дном, по отношению к газоотводной трубке. Поднесем пробирку отверстием к пламени спиртовки – слышится характерный хлопок.
Хлопок – это признак того, что в пробирке содержится водород. При поднесении пробирки к пламени водород вступает в реакцию с кислородом, содержащимся в воздухе. При малых количествах реакция кислорода и водорода сопровождается хлопком. Более подробно об этой реакции будет рассказано в следующем параграфе.
Использование водорода
В химической промышленности водород используют при производстве аммиака, мыла и пластмасс. В пищевой промышленности с помощью водорода из жидких растительных масел делают маргарин. Водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколько ужасных катастроф, когда дирижабли взрывались и сгорали. В наше время дирижабли наполняют газом гелием. Водород используют также в качестве ракетного топлива. Когда-нибудь водород, возможно, будут широко применять как топливо для легковых и грузовых автомобилей. Водородные двигатели не загрязняют окружающей среды и выделяют только водяной пар (правда, само получение водорода приводит к некоторому загрязнению окружающей среды). Наше Солнце в основном состоит из водорода. Солнечное тепло и свет — это результат выделения ядерной энергии при слиянии ядер водорода.
Использование водорода в качестве топлива (экономическая эффективность)
Важнейшей характеристикой веществ, используемых в качестве топлива, является их теплота сгорания. Из курса общей химии известно, что реакция взаимодействия водорода с кислородом происходит с выделением тепла. Если взять 1 моль H2 (2 г) и 0,5 моль O2 (16 г) при стандартных условиях и возбудить реакцию, то согласно уравнению
- Н2 + 0,5 О2= Н2О
после завершения реакции образуется 1 моль H2O (18 г) с выделением энергии 285,8 кДж/моль (для сравнения: теплота сгорания ацетилена составляет 1300 кДж/моль, пропана — 2200 кДж/моль). 1 м³ водорода весит 89,8 г (44,9 моль). Поэтому для получения 1 м³ водорода будет затрачено 12832,4 кДж энергии. С учётом того, что 1 кВт·ч = 3600 кДж, получим 3,56 кВт·ч электроэнергии. Зная тариф на 1 кВт·ч электричества и стоимость 1 м³ газа, можно делать вывод о целесообразности перехода на водородное топливо.
Например, экспериментальная модель Honda FCX 3 поколения с баком водорода 156 л (содержит 3,12 кг водорода под давлением 25 МПа) проезжает 355 км. Соответственно из 3,12 кг H2 получается 123,8 кВт·ч. На 100 км расход энергии составит 36,97 кВт·ч. Зная стоимость электроэнергии, стоимость газа или бензина, их расход для автомобиля на 100 км легко подсчитать отрицательный экономический эффект перехода автомобилей на водородное топливо. Скажем (Россия 2008), 10 центов за кВт·ч электроэнергии приводят к тому, что 1 м³ водорода приводят к цене 35,6 цента, а с учётом КПД разложения воды 40-45 центов, такое же количество кВт·ч от сжигания бензина стоит 12832,4кДж/42000кДж/0,7кг/л*80центов/л=34 цента по розничным ценам, тогда как для водорода мы высчитывали идеальный вариант, без учёта транспортировки, амортизации оборудования и т. д. Для метана с энергией сгорания около 39 МДж на м³ результат будет ниже в два-четыре раза из-за разницы в цене (1м³ для Украины стоит 179$, а для Европы 350$). То есть эквивалентное количество метана будет стоить 10-20 центов.
Однако не следует забывать того, что при сжигании водорода мы получаем чистую воду, из которой его и добыли. То есть имеем возобновляемый запасатель энергии без вреда для окружающей среды, в отличие от газа или бензина, которые являются первичными источниками энергии.
Возможности получения водорода
Химическим путем сегодня выделение водорода производится в промышленных объемах.
Для этого используется реакция метана и воды. Метан входит в состав природного газа.
Выделение водорода таким способом производится при высоких температурах. Если стоит цель
произвести извлечение водорода в условиях лаборатории, не обязательно использовать природное
сырье. Наиболее часто принято использовать более простые исходные вещества, которые облегчают
извлечение водорода.
Разложение воды под действием электрического тока является самым простым способом организовать
извлечение водорода в лабораторных экспериментах. Выделение водорода таким простым
способом иногда используется и в процессе его производства в промышленности. Все зависит от
того, какие потребности в данном химическом элементе существуют на предприятии. Также часто используется
в лабораториях извлечение водорода при помощи взаимодействия цинка и соляной кислоты. Если существует
необходимость, в промышленности производят концентрирование водорода.
Концентрирование водорода может осуществляться с помощью различных процессов:
- мембранного;
- короткоциклового;
- криогенного.
С точки зрения материальных затрат и эффективности процесса концентрирование водорода предпочтительнее
производить мембранным способом.
Что такое водород
Водород является элементом с атомный номер 1 и символ ЧАС, Это элемент, который находится в верхней части периодической таблицы. Водород имеет три естественных изотопы. Это протий, дейтерий и тритий. Они отличаются друг от друга количеством нейтронов, которые они имеют в своем ядре. Среди этих изотопов наиболее часто встречающимся изотопом является протия, Обилие протия в природе составляет около 98%. Поэтому термин водород обычно относится к протию.
Водород не имеет нейтронов, только один протон и один электрон. Водород имеет только один s орбитальная и никаких других орбиталей. Следовательно, единственный электрон, которым обладает атом водорода, находится в орбитали. Поскольку этот электрон один и непарный, водород может образовывать H+ ион легко, удалив этот электрон. Наличие неспаренного электрона делает атом водорода нестабильным. Следовательно, водород имеет тенденцию образовывать ковалентные связи со многими различными элементами, разделяя с ними свой электрон.
Наиболее распространенной формой водорода, которая встречается в природе, являются молекулы воды. Два атома водорода ковалентно связаны с одним атомом кислорода в молекуле воды. Молекулярная формула воды дана как H2О. Помимо этого, водород содержится в углеводородах, многих распространенных полимерах и других органических и неорганических веществах. Водород находится в атмосфере в виде газообразного водорода. Молекулярная формула газообразного водорода H2, Там два атома водорода связаны через ковалентную связь, разделяя единственный имеющийся у них электрон.

Рисунок 01: Химическая структура Н и Н2
При стандартной температуре и давлении водород является бесцветным, без запаха и нетоксичным газом. Это очень огнеопасно. Когда Н2 газ реагирует с металлическими элементами, образует Н– анион. Этот анион называется гидридом. Связь между металлом и гидридом является ионной, и атом водорода имеет два электрона (парных) в гидридном анионе.