Гост 32918-2014 нефть. метод определения сероводорода, метил- и этилмеркаптанов
Содержание:
- Область применения
- Биологическая роль
- Синтез
- Средства измерений, вспомогательные устройства, материалы, реактивы
- Выполнение измерений
- Требования безопасности
- Метилакрилат (СН2 =СНООСН3) класс опасности — 4
- 8. Выполнение измерений
- Вычисление результатов измерений
- Химические свойства
- Средства измерений, вспомогательные устройства, материалы, реактивы
- Физические свойства
- Вычисление результатов измерений
Область применения
Методические указания по определению концентраций загрязняющих веществ в атмосферном воздухе предназначены для использования в системе госсанэпиднадзора России, при проведении аналитического контроля ведомственными лабораториями предприятий, а также научно-исследовательских институтов, работающих в области гигиены окружающей среды. Методические указания разработаны с целью обеспечения контроля соответствия уровня содержания загрязняющих веществ их гигиеническим нормам — предельно допустимым концентрациям (ПДК) и ориентировочно безопасным уровням воздействия (ОБУВ) — и являются обязательными при осуществлении аналитического контроля атмосферного воздуха.
Включенные в сборник методические указания разработаны в соответствии с требованиями ГОСТов 8.010-90 «Методики выполнения измерений», 17.2.4.02-81 «Охрана природы. Атмосфера. Общие требования к методам определения загрязняющих веществ», 17.0.0.02-79 «Охрана природы. Метрологическое обеспечение контроля загрязненности атмосферы, поверхностных вод и почвы. Основные положения», Р 1.5-92 (пункты 7.3). Все методики анализа метрологически аттестованы и обеспечивают определение веществ с нижним пределом обнаружения не выше 0,8 ПДКм.р. и суммарной погрешностью, не превышающей 25 %, с отбором пробы воздуха в течение 20 — 30 мин при определении максимальной разовой концентрации или круглосуточном отборе пробы при определении среднесуточной концентрации.
В сборнике представлены методики контроля атмосферного воздуха за содержанием нормируемых соединений. Методики основаны на использовании физико-химических методов анализа — фотометрии, потенциометрии, тонкослойной хроматографии с различного вида детектированием, ионной хроматографии, газожидкостной, высокоэффективной жидкостной хроматографии, хромато-масс-спектрометрии. Приведено 55методик по измерению концентраций 140 загрязняющих веществ на уровне и ниже их гигиенических нормативов в атмосферном воздухе населенных мест. Контролируемые вещества относятся к различным классам соединений: неорганическим веществам, ароматическим углеводородам, спиртам, органическим кислотам, эфирам, альдегидам, азотсодержащим углеводородам, фенолам, меркаптанам.
Методические указания одобрены и рекомендованы Комиссией по санитарно-гигиеническому нормированию «Лабораторно-инструментальное дело и метрологическое обеспечение» Госкомсанэпиднадзора России и бюро секции по физико-химическим методам исследования объектов окружающей среды Проблемной комиссии «Научные основы экологии человека и гигиены окружающей среды».
|
УТВЕРЖДЕНО Первым заместителем Председателя Госкомсанэпиднадзора России — заместителем Главного государственного санитарного врача Российской Федерации 31 октября 1996 г. МУК 4.1.623-96 Дата введения — с момента утверждения |
4.1. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ
Методические указания по газохроматографическому определению метил- и этилмеркаптанов в атмосферном воздухе
Настоящие методические указания устанавливают газохроматографическую методику количественного химического анализа атмосферного воздуха для раздельного определения в нем содержания метил- и этилмеркаптанов в диапазоне концентраций 7´10-6 — 5´10-2 мг/м3.
|
CH3SH |
Мол. масса 48,10 |
Метилмеркаптан (ММК) — газ с резким, специфическим запахом. Температура кипения — 5,95 °C, плотность — 0,8665 г/дм3. Хорошо растворим в органических растворителях. Растворимость в воде — 0,0233 г/см3.
Метилмеркаптан обладает высокой токсичностью, относится к 2-му классу опасности. Максимальная разовая ПДК для атмосферного воздуха населенных мест составляет 1´10-4 мг/м3.
|
C2H5SH |
Мол. масса, 62,13 |
Этилмеркаптан (ЭМК) — бесцветная прозрачная жидкость с резким, специфическим запахом. Температура кипения — 35 °C, плотность — 0,8391 г/см3, температура плавления — 144,4 °C. Хорошо растворим в органических растворителях. Растворимость в воде — 0,015 г/см3. В воздухе находится в виде паров.
Этилмеркаптан обладает высокой токсичностью, относится к 3-му классу опасности. ОБУВ для воздуха населенных мест составляет 5´10-5 мг/м3.
Биологическая роль
Смесь тиолов содержится в веществе, выделяемом скунсами, а также в продуктах гниения белков.
Аминокислота цистеин HSCH2CH(NH2)COOH, содержащая меркаптогруппу, входит в состав всех белков, а окисление цистеина с образованием дисульфидных мостиков в ходе посттрансляционной модификации белков является важнейшим фактором при формировании их третичной структуры. Высокая механическая прочность кератинов обусловлена, в том числе, и высокой степенью сшитости за счёт образования большого количества дисульфидных мостиков: так, например, содержание цистеина в кератине волоса человека, составляет ~14 %, а в некоторых кератинах доля цистеина может достигать и 30 %.
Трипептид глутатион, в состав которого также входит цистеин, является коферментом глутатионпероксидаз и играет важную роль в окислительно-восстановительных процессах в живых организмах.
Также существенное биологическое значение имеет метаболическое нитрозирование тиолов: глутатион и цистеиновые остатки белков при взаимодействии с активными формами азота образуют S-нитрозопроизводные, которые являются физиологическим депо оксида азота.
Синтез
Алифатические тиолы
Старейшим методом получения тиолов является алкилирование гидросульфидов щелочных металлов с первичными и вторичными алкилгалогенидами, в качестве алкилирующих агентов также могут выступать алкилсульфаты или алкилсульфонаты. Реакция идёт по механизму бимолекулярного нуклеофильного замещения SN2 и проводится обычно в спиртовых растворах, поскольку тиолят-ионы также являются сильными нуклеофилами, побочной реакцией является их дальнейшее алкилирование до сульфидов, снижающее выход тиолов; для повышения выхода необходимо использовать большой избыток гидросульфида:
-
- RX+HS−→RSH+X−{\displaystyle {\mathsf {RX+HS^{-}\rightarrow RSH+X^{-}}}}
-
- RSH+HS−→RS−+H2S{\displaystyle {\mathsf {RSH+HS^{-}\rightarrow RS^{-}+H_{2}S}}}
-
- RS−+RX→R2S+X−; X=Cl, Br, I, ROSO{\displaystyle {\mathsf {RS^{-}+RX\rightarrow R_{2}S+X^{-};\ \ X=Cl,\ Br,\ I,\ ROSO}}}
Более удобным методом синтеза тиолов является алкилирование тиомочевины с образованием алкилтиурониевых солей и их последующим щелочным гидролизом:
Преимуществом этого метода являются легкая очистка перекристаллизацией тиурониевых солей и достаточно высокие общие выходы тиолов.
Своего рода вариацией этого метода, позволяющего получить тиолы без побочного образования сульфидов, является алкилирование с последующим гидролизом ксантогенатов:
-
- C2H5CSSK+RX→C2H5CSSR+KX{\displaystyle {\mathsf {C_{2}H_{5}CSSK+RX\rightarrow C_{2}H_{5}CSSR+KX}}}
-
- C2H5CSSR+H2O→RSH+C2H5OH+CSO{\displaystyle {\mathsf {C_{2}H_{5}CSSR+H_{2}O\rightarrow RSH+C_{2}H_{5}OH+CSO}}}
или тиоацетатов:
-
- CH3COSK+RX→CH3COSR+KX{\displaystyle {\mathsf {CH_{3}COSK+RX\rightarrow CH_{3}COSR+KX}}}
-
- CH3COSR+H2O→RSH+CH3COOH{\displaystyle {\mathsf {CH_{3}COSR+H_{2}O\rightarrow RSH+CH_{3}COOH}}}
Тиолы также могут быть синтезированы из алкилгалогенидов через соли Бунте — соли S-алкилтиосульфокислот, получаемые алкилированием тиосульфата натрия, которые при кислотном гидролизе образуют тиолы:
-
- RX+Na2S2O3→RSSO3Na+NaX{\displaystyle {\mathsf {RX+Na_{2}S_{2}O_{3}\rightarrow RSSO_{3}Na+NaX}}}
-
- RSSO3Na+H2O→RSH+NaHSO4{\displaystyle {\mathsf {RSSO_{3}Na+H_{2}O\rightarrow RSH+NaHSO_{4}}}}
В условиях кислотного катализа сероводород может присоединяться к алкенам с образованием тиолов:
-
- (CH3)2C=CH2+H2S→(CH3)3CSH{\displaystyle {\mathsf {(CH_{3})_{2}C{\text{=}}CH_{2}+H_{2}S\rightarrow (CH_{3})_{3}CSH}}}
Модификацией этого метода является присоединение тиоуксусной кислоты к алкенам с дальнейшим гидролизом образовавшегося алкилтиоацетата:
-
- RCH=CH2+CH3COSH→RCH2CH2SCOCH3{\displaystyle {\mathsf {RCH{\text{=}}CH_{2}+CH_{3}COSH\rightarrow RCH_{2}CH_{2}SCOCH_{3}}}}
-
- RCH2CH2SOCCH3+OH−→RCH2CH2SH+CH3COO−{\displaystyle {\mathsf {RCH_{2}CH_{2}SOCCH_{3}+OH^{-}\rightarrow RCH_{2}CH_{2}SH+CH_{3}COO^{-}}}}
Ароматические тиолы
Ароматические тиолы могут быть синтезированы восстановлением производных ароматических сульфокислот, так, например, тиофенол синтезируется восстановлением бензолсульфохлорида цинком в кислой среде:
-
- C6H5SO2Cl→HC6H5SH{\displaystyle {\mathsf {C_{6}H_{5}SO_{2}Cl{\xrightarrow{}}C_{6}H_{5}SH}}}
Ароматические тиолы также могут быть синтезированы взаимодействием арилдиазониевых солей с гидросульфидами:
-
- ArN2X→HS−ArSH{\displaystyle {\mathsf {ArN_{2}X{\xrightarrow{HS^{-}}}ArSH}}}
или ксантогенатами:
-
- ArN2X→ROC(=S)S−ROC(=S)SAr{\displaystyle {\mathsf {ArN_{2}X{\xrightarrow{ROC({\text{=}}S)S^{-}}}ROC({\text{=}}S)SAr}}}
- ROC(=S)SAr→H2OArSH+ROH+COS{\displaystyle {\mathsf {ROC({\text{=}}S)SAr{\xrightarrow{H_{2}O}}ArSH+ROH+COS}}}
Общие методы
Общим методом синтеза алифатических и ароматических тиолов является взаимодействие реактивов Гриньяра с серой:
-
- RMgX+S→RSMgX{\displaystyle {\mathsf {RMgX+S\rightarrow RSMgX}}}
- RSMgX+H2O→RSH+Mg(OH)X{\displaystyle {\mathsf {RSMgX+H_{2}O\rightarrow RSH+Mg(OH)X}}}
Средства измерений, вспомогательные устройства, материалы, реактивы
При выполнении измерений применяют следующие средства измерений, вспомогательные устройства, материалы и реактивы.
3.1. Средства измерений
|
Хроматограф газовый с пламенно-фотометрическим или фотоионизационным детектором |
|
|
Вакуумный водоструйный насос |
ГОСТ 10696-75 |
|
Весы аналитические ВЛА-2 |
ГОСТ 24104-80 |
|
Генератор ГПС-3 или другая аппаратура этого типа |
|
|
Генератор водорода СГС-2 |
ТУ 6-09-5375-88 |
|
Динамическая установка «Микрогаз» (модель 4 или 5) |
ТУ 2.840.118-91 |
|
Лупа измерительная |
|
|
Линейка измерительная |
ГОСТ 8304-75 |
|
Микрокомпрессор РК-1 |
ТУ 25-06-926-77 |
|
Посуда мерная стеклянная |
ГОСТ 1770-74, 20292-74, 25336-82 |
|
Сушильный шкаф |
ТУ 64-1-1411-768 |
|
Секундомер |
ГОСТ 5072-79 |
|
Термодесорбционная приставка |
ТУ 840.26-91 |
|
Термометр ТМ-1 |
ГОСТ 112-78Е |
|
Чашка фарфоровая для выпаривания диаметром 12 см |
ГОСТ 9147-73 |
|
Электроаспиратор М-822 |
МРТУ 42-862-64 |
3.2. Вспомогательные устройства
|
Дистиллятор |
ТУ 61-1-721-79 |
|
Хроматографическая колонка (3 м´4 мм) из стекла или тефлона |
|
|
Колонка-концентратор из стекла (8 см´5 см) |
|
|
Трубка из стекла (20 см´15 мм) для кондиционирования сорбента, используемого для концентрирования меркаптанов |
|
|
Форколонка из стекла (4 см´5 мм) для идентификации |
|
|
Эксикатор с притертой крышкой |
3.3. Материалы
|
Азот |
|
|
Водород технический |
|
|
Стекловолокно обезжиренное |
ГОСТ 10176-74 |
3.4. Реактивы
|
Натрия гидроксид, ч. |
|
|
Натрия углекислый кислый, х. ч. |
|
|
Меркаптаны C1 — C4, ч., в запаянных тефлоновых ампулах (источники микротоков меркаптанов в ампулах, изготовлены и аттестованы во ВНИИМ им. Д.И. Менделеева, г. Санкт-Петербург) |
|
|
Ортофосфорная кислота, ч. д. а. |
ГОСТ 6552-58 |
|
Полидифенилфталид (отечественный пористый полимерный сорбент) для концентрирования меркаптанов, зернение 0,5 — 0,6 мм |
|
|
Полифениловый эфир, ч. д. а. |
ТУ 6П-61-68 |
|
Хлороформ, х. ч. |
ГОСТ 20015-79 |
|
Хроматон N-Супер (фирма «Лахема» Чехия), (фракция 0,1 — 0,125 мм) |
|
|
Полихром-1 (фракция 0,5 — 0,9) |
ТУ 10П-176-68 |
Выполнение измерений
После отбора проб воздуха трубки с сорбентом помещают в термодесорбционное устройство. Десорбцию и анализ проводят в условиях установления градуировочной характеристики.
Идентификацию пиков меркаптанов на хроматограмме проводят по времени удерживания чистых веществ.
При использовании универсального фотоионизационного детектора проводят дополнительную групповую идентификацию сернистых соединений методом реакционно-сорбционного концентрирования примесей. Для этого параллельно отбирают вторую пробу воздуха, но перед сорбционной трубкой устанавливают короткую форколонку (4 см´5 мм) из стекла. После отбора содержимое второй трубки анализируют, как описано выше. Сравнение первой и второй хроматограмм позволяет определить принадлежность пиков к углеводородам или сернистым соединениям, поскольку форколонка задерживает сернистые соединения, и в концентратор проходят лишь углеводороды.
На полученной хроматограмме определяют площади пиков меркаптанов и по градуировочной характеристике определяют их массу.
Требования безопасности
4.1.При работе с реактивами соблюдают требования безопасности, установленные для работы с токсичными, едкими и легковоспламеняющимися веществами по ГОСТу 12.1.005-88.
4.2. Все работы по приготовлению стандартных смесей меркаптанов проводят под тягой. Газ (азот или гелий), содержащий примеси меркаптанов, после установки «Микрогаз» или «ГСП-3» пропускают через поглотительную склянку с 5 %-ным раствором гидроокиси натрия. Ампулы с меркаптанами хранят в эксикаторе с хорошо притертой крышкой, помещенном в холодильник.
4.3. При выполнении измерений с использованием газового хроматографа соблюдают правила электробезопасности в соответствии с ГОСТом 12.1.019-79 и инструкцией по эксплуатации приборов, используемых в настоящей методике.
Метилакрилат (СН2 =СНООСН3) класс опасности — 4
(метиловый
эфир акриловой кислоты)
Бесцветная, высококипящая,
малолетучая,легковоспламеняющаяся жид-кость с резким запахом, легче воды, плохо растворяется в
воде, пары тяжелее воздуха скапливаются в низких участках поверхности, подвалах
тоннелях, с воздухом образуют взрывоопасные смеси. Температура затвердевания -75С,
при температуре +80,5С кипит.
Метилакрилат используется в производстве органического стекла, в электротехнической
промышленности, в производстве пластических бинтов и пластырей, для пропитки
тканей, склеивания картона, фанеры, тканей и т.п., для сополимеризации с
другими мономерами.
Метилакрилат перевозят в контейнерах,
железнодорожных цистернах, баллонах, которые являются временным его хранилищем.
Обычно метилакрилат хранят в наземных вертикальных цилиндрических резервуарах (объемом 50–5000м3) с
коэффициентом заполнения 0,9-0,95 при атмосферном давлении и температуре
окружающей среды. Максимальный объем хранения 76 тонн.
Предельно допустимая концентрация в воздухе рабочей зоны производственных
помещений 5 мг/м3, в атмосферном воздухе населенных пунктов 0,01
мг/м3, в воде водоемов 0,02 мг/л. опасен при вдыхании. Острые
отравления оказывают наркотическое и общеядовитое действие. Порог ощущения
запаха 1,7 мг/м3. При концентрациях 250 – 500 мг/м3
наблюдается раздражение слизистых оболочек носа и глаз, снижение артериального давле-ния, повышение содержания холестерина в крови, при
концентрации 25 г/м3 – сильное выделение мокроты. Признаки
поражения: расстройство дыхания, головная боль, резь в
глазах, слабость, кашель, судороги, при попадании на кожу — воспаление с
образованием пузырей, дерматиты, пиодермии, гипергид-роз.
При
ликвидации аварий с проливом (выбросом)
метилакрилата изолиро-вать опасную зону в радиусе не
менее 400 м, удалить из нее людей, держаться наветренной стороны, избегать
низких мест, соблюдать меры пожарной безопасности, не курить. В опасную зону
входить в изолирующих противогазах или дыхательных аппаратах (ИП-4М, ИП-5,
ИП-6, ИВА-24М, АИР-324, АСВ-2) и средствах защиты кожи (костюм Л-1, ОЗК,
«ПРИЗ», «ВЕКТОР», «КАИС»). На удалении от источника заражения более 400 м для защиты органов дыхания можно использовать фильтрующие промышленные
противогазы большого и малого габарита с коробкой марки А,
гражданские и детские противогазы ГП-5, ГП-7, ПДФ-2Д, ПДФ-2Ш с дополнительными
патронами ДПГ-1, ДПГ-3, при малых концентрациях – респираторы РПГ-67 и РУ-60М с
коробкой марки А.
Наличие метилакрилата определяют:
В воздухе рабочей зоны
производственных помещений: оптико-абсорбционны-ми анализаторами ПГА-10,
ПГА-11.
На
открытом пространстве: приборами СИП
«КОРСАР-Х».
В
закрытом помещении: приборами СИП «ВЕГА-М»
Нейтрализуют метилакрилат10%-ным водным
раствором гипохло-рита кальция (например, 100 кг гипохлорита
кальция и 900 л воды) с нормойрасхода 25
тонн раствора на 1 тонну метилакрилата. При пожаре тушить распыленной водой,
воздушно-механической пеной.
Для распыления воды и растворов
применяют поливомоечные и пожарные машины, авторазливочные станции (ПМ-130, АЦ,
АРС-14, АРС-15), мотопомпы (МП-800), а также имеющиеся на химически опасных
объектах гидранты и спецсистемы.
Место разлива засыпают
активным углем или углем катализатором, обрабатывают 10%-ным водным раствором
гипохлорита кальция.
Для утилизации
загрязненного грунта на месте разлива срезают поверхностный слой грунта на глубину
загрязнения, собирают и вывозят на утилизацию с помощью землеройно-транспортных машин (бульдозеров, скреперов,
автогрейдеров, самосвалов). Места срезов засыпают свежим слоем грунта,
промывают водой в контрольных целях.
Действия
руководителя: изолировать опасную
зону, удалить из нее людей, держаться наветренной стороны, избегать низких
мест, соблюдать меры пожарной безопасности, не курить, в зону химического
заражения входить только в полной защитной одежде.
Оказание
первой помощи:
В зараженной зоне: надеть противогаз,немедленноэвакуировать из зоны
заражения.
После эвакуации из зараженной зоны: обильное промывание кожи и слизистых 2%-ным
раствором борной кислоты или водой; при нарушении дыхания ингаляция кислорода,
искусственная вентиляция легких.
8. Выполнение измерений
После отбора пробы воздуха сорбционную колонку, не вынимая из сосуда Дьюара, присоединяют к входу хроматографической колонки длиной 2 м к крану 5 (см. рис.) в положение «отбор пробы». Далее анализируют пробу в условиях стандартных паровоздушных смесей согласно п. .
В этих условиях время удерживания метилмеркаптана — около 2 мин, этилмеркаптана — около 4 мин.
На хроматограмме рассчитывают площади пиков метил- и этилмеркаптанов. Массу метил- и этилмеркаптана в пробе находят путем умножения найденной по градуировочной характеристике массы сероуглерода на соответствующий коэффициент. Для метилмеркаптана коэффициент равен 1,26, для этилмеркаптана — 1,63.
Вычисление результатов измерений
Концентрацию метил- и этилмеркаптанов в атмосферном воздухе (мг/м3) вычисляют по формуле:
где
m — масса метил- и этилмеркаптанов, рассчитанная согласно п. , мкг;
V — объем пробы воздуха, приведенный к нормальным условиям, дм3;
где
Р — атмосферное давление при отборе пробы воздуха, мм рт. ст.;
t — температура воздуха в местах отбора проб, °C;
Vt — объем пробы воздуха, дм3.
Методические указания разработаны М.Т. Джапаридзе, Н.А. Просвирниковой (НИИ «Синтез», г. Москва), Ю.И. Толчинским (ЦАО, г. Долгопрудный).
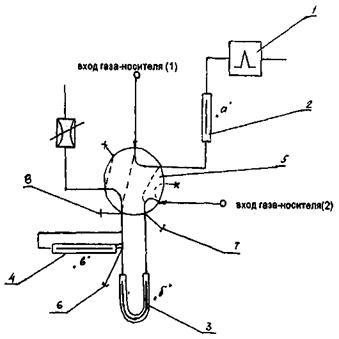
Рис. 1. Схема соединения колонок.
1 — пламенно-фотометрический детектор, 2 — разделительная колонка (колонка «а»), 3 — сорбционная колонка (колонка «б»), 4 — защитная колонка (колонка «в»), 5 — кран обогатительного устройства, 6, 7, 8 — хроматографические тройники (для ввода пробы в различные точки газовой системы).
Кран и переходники термотестированы при температуре 170 °С.
Химические свойства
Кислотность
Тиолы являются слабыми кислотами, образуя с гидроксидами щелочных и щелочноземельных металлов растворимые в воде тиоляты (меркаптиды), с солями тяжелых металлов — нерастворимые меркаптиды. Являются значительно более сильными кислотами, чем соответствующие кислородные спирты.
|
|
|
|---|---|
|
|
|
|
|
|
|
|
|
|
|
|
|
н-C3H7SH |
|
|
трет-C4H9SH |
|
Тиолят-анионы высоконуклеофильны, и многие реакции замещения водорода группы -SH протекают через промежуточное образование тиолятов.
Так, тиолы алкилируются под действием алкилгалогенидов:
-
- RS−+R1Hal→RSR1+Hal−{\displaystyle {\mathsf {RS^{-}+R^{1}Hal\rightarrow RSR^{1}+Hal^{-}}}}
Тиолы в присутствии оснований (пиридина, третичных аминов) ацилируются с образованием S-ацилпроизводных:
-
- RSH+R1C(O)Hal→R1C(O)SR+HX{\displaystyle {\mathsf {RSH+R^{1}C(O)Hal\rightarrow R^{1}C(O)SR+HX}}}
Нитрозирование тиолов азотистой кислотой или нитрозилхлоридом ведёт к неустойчивым окрашенным нитрозилтиолам (тионитритам):
-
- RSH+HNO2→RSNO+H2O{\displaystyle {\mathsf {RSH+HNO_{2}\rightarrow RSNO+H_{2}O}}}
Эта реакция используется как качественная реакция на тиолы.
Присоединение
Тиолы вступают в реакции присоединения к ацетиленовым, этиленовым и алленовым углеводородам. Реакция может протекать по нуклеофильному, электрофильному либо радикальному механизму.
Окисление
Тиолы окисляются самым широким спектром окислителей (кислород, пероксиды, оксиды азота, галогены и др.). Мягкие окислители (йод, алифатические сульфоксиды, активированный диоксид марганца и т. п.) реагируют с тиолами с образованием дисульфидов:
-
- 2RSH→ORSSR{\displaystyle {\mathsf {2RSH{\xrightarrow{}}RSSR}}}
которые, в свою очередь, при реакции с хлором образуют тиохлориды:
-
- RSSR+Cl2→2RSCl{\displaystyle {\mathsf {RSSR+Cl_{2}\rightarrow 2RSCl}}}
При действии более жёстких окислителей (например, перманганата) сначала образуются сульфиновые кислоты и далее — сульфокислоты:
-
- RSH→ORSO2H→ORSO3H{\displaystyle {\mathsf {RSH{\xrightarrow{}}RSO_{2}H{\xrightarrow{}}RSO_{3}H}}}
В случае окисления тетраацетатом свинца (CH3COO)4Pb в присутствии спиртов окисление идёт с образованием сульфинатов — соответствующих эфиров сульфиновых кислот:
-
- RSH+CH3OH→ORSO2OCH3{\displaystyle {\mathsf {RSH+CH_{3}OH{\xrightarrow{}}RSO_{2}OCH_{3}}}}
В присутствии воды тиолы окисляются хлором до соответствующих сульфонилхлоридов:
-
- RSH→H2O,Cl2RSO2Cl{\displaystyle {\mathsf {RSH{\xrightarrow{H_{2}O,Cl_{2}}}RSO_{2}Cl}}}
Средства измерений, вспомогательные устройства, материалы, реактивы
При выполнении измерений применяют следующие средства измерений, вспомогательные устройства, материалы и реактивы.
3.1. Средства измерений
|
Хроматограф газовый лабораторный серии «Цвет-500» с пламенно-фотометрическим детектором или другой модели |
|
|
Весы аналитические лабораторные, 2-го класса типа ВЛР-200, ВЛА-200 |
|
|
Газовые бюретки, вместимостью 100, 200, 1000 см3 |
ГОСТ 1770-74 |
|
Газовый счетчик барабанного типа ГСБ |
ТУ 2504-2261-75 |
|
Колбы мерные вместимостью 25, 50, 100 см3 |
ГОСТ 25366-82 |
|
Линейка измерительная |
ГОСТ 8.222-76 |
|
Лупа измерительная ЛИ-6 |
|
|
Меры массы Г-2-210 |
ГОСТ 7328-88 |
|
Микрошприцы МШ-1, МШ-10, МШ-10М |
ТУ 2.833.106 |
|
Секундомер типа СДС пр-1-2-000 |
ГОСТ 5072-79 |
|
Термометр ТЛ-4, верхний предел измерений 150 °C |
|
|
Установка динамического смешения «Микрогаз-1» |
ТУ 2.956-057 |
|
Шприцы медицинские, вместимостью 1, 5, 10 см3 |
ТУ 64-1-378-83 |
3.2. Вспомогательные устройства
|
Хроматографические колонки из фторопласта (Ф-4Д) длиной 4 м и 2 м, внутренний диаметр 4 мм |
|
|
Баня водяная или песчаная |
ТУ 46-775-75 |
|
Дистиллятор |
|
|
Микронагреватель типа МР5-4Г, производительность не менее 100 дм3/мин |
ТУ 333-1080 |
|
Обогатительное устройство (из комплекта ЗИП хроматографа) |
|
|
Печь муфельная ПМ-4 |
ТУ 79-337-77 |
|
Редуктор водородный |
ТУ 26-05-463-76 |
|
Редуктор кислородный |
ТУ 26-05-235-70 |
|
Сорбционная колонка из фторопласта (Ф-4Д) длиной 25 см, внутренний диаметр 4 мм |
|
|
Сосуд криогенный СК-6, СК-10 |
ТУ 26-04-622-88 |
|
Стаканы для взвешивания, вместимостью 25, 50 см |
ГОСТ 25366-82 |
|
Стеклянный патрон, вместимостью 50 — 200 см3 |
|
|
Чашка выпарительная № 4 или № 5 |
ГОСТ 9147-80 |
|
Шкаф сушильный вакуумный типа ШС |
ТУ 25-02-21088-78 |
3.3. Материалы
|
Азот сжатый |
ГОСТ 9293-84 |
|
или гелий сжатый |
ТУ 51940-80 |
|
Азот жидкий |
|
|
Водород сжатый |
|
|
Воздух сжатый |
|
|
Стекловата |
3.4. Реактивы
|
Ангидрон, ч. |
ТУ 6-09-3880-75 |
|
Вода дистиллированная |
|
|
Гептан, х. ч. |
ТУ 6-09-06-522-75 |
|
Диоктилфталат 20 % на хроматоне N-AW-DMCS зернением 0,16 — 0,22 мм, готовая фаза (производство «Лахема», Чехия) |
|
|
Метилмеркаптан, производство Шеринг-Кахльбаум АГ, Германия или производства АО «Волжский оргсинтез» (чистота более 98 %) |
|
|
Спирт этиловый ректификат |
|
|
Полисорб-1 зернением 0,25 — 0,5 мм |
|
|
Этилмеркаптан, производство Шеринг-Кахльбаум АГ, Германия или производства АО «Волжский оргсинтез» (чистота более 98 %) |
ТУ 6-09-13-311-74 |
Физические свойства
Полярность связи S−H{\displaystyle {\ce {S-H}}} значительно ниже, чем полярность связи O-H, в результате водородные связи между молекулами тиолов значительно слабее, чем у спиртов, и вследствие этого их температура кипения ниже, чем у соответствующих спиртов.
|
|
|
|
|
|
|
|
H-OH(H2O) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Тиолы малорастворимы в воде, но хорошо растворяются в этаноле, диэтиловом эфире и других органических растворителях.
Низшие алифатические тиолы являются легколетучими жидкостями с отвратительным запахом, причём их запах ощущается обонянием человека в чрезвычайно низких концентрациях — 10−7−10−8 моль/л. Это свойство используется для одорирования природного бытового газа, не имеющего запаха — добавка летучих тиолов к газу позволяет обнаруживать людям утечки газа в помещениях, по запаху.
Вычисление результатов измерений
Концентрацию меркаптанов в атмосферном воздухе (мг/м3) вычисляют по формуле:
где
m — масса меркаптана, найденная по градуировочной характеристике, мкг;
V — объем пробы воздуха, пропущенного через сорбционную трубку с сорбентом, приведенный к стандартным условиям, дм3.
где
Р — атмосферное давление при отборе пробы воздуха, мм рт. ст.;
Vt — объем пробы воздуха, дм3;
t — температура воздуха в месте отбора проб, °C.
Методические указания разработаны А.Г. Малышевой, (НИИ экологии человека и гигиены окружающей среды им. А.Н. Сысина РАМН, г. Москва), Ю.С. Друговым, А.А. Беззубовым (Аналитический центр геологического института РАН, г. Москва).