Как сделать водородный генератор своими руками
Содержание:
Общие сведения
При пропускании электрического тока через раствор происходит физико-химический процесс, названный электролизом. Заключается он в способности выделения веществами вторичных продуктов. Термин произошёл от греческого λυσις, что в переводе обозначает «разрушение». Его понятие довольно точно описывает происходящий процесс.
Любое вещество состоит из совокупности связных атомов и молекул, которые образуют ионы при потере или присоединении электронов. Когда их количество превышает число протонов заряженная частица становится отрицательной. Называют её катионом. Если же ион потерял электрон, то он становится положительно заряженным. В этом случае его называют анионом.
Чтобы связи в веществе нарушились, тем самым электрически нейтральный ион получил знак, нужно выполнить какое-либо воздействие. Для жидкости это и есть электролиз — разделение частиц под действием электрического тока. Но при этом элементы обладают способностью диссоциировать. Другими словами, распадаться при смешивании на два или более молекулярных элемента. В 1887 году учёный Сванте Аррениус смог сформулировать теорию о диссоциации. Она в дальнейшем была дополнена положением о гидратации.
В результате ряда экспериментов все жидкие вещества были разделены на два вида:
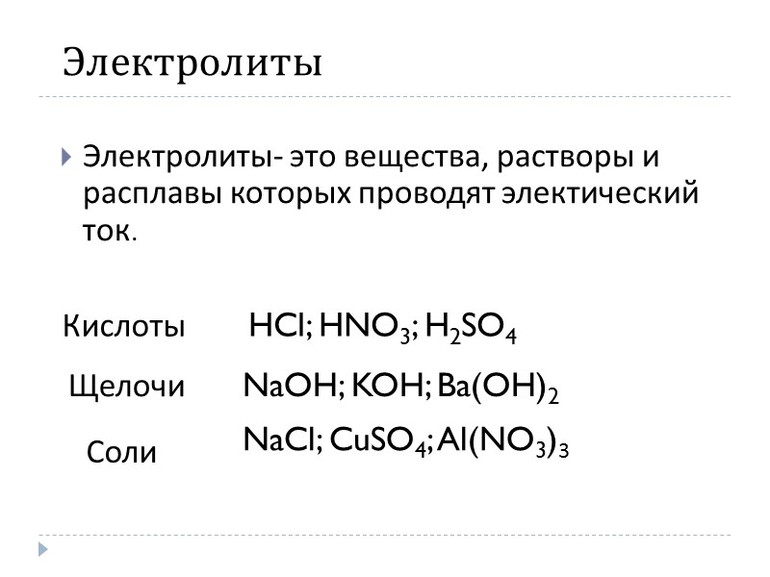
- Электролиты — элементы проводящие электрический ток. К ним относятся вещества описывающиеся ковалентной полярной и ионной связью. Например, растворимые кислоты, соли, основания.
- Неэлектролиты — растворы не способные пропускать через себя электричество. Это нерастворимые в воде вещества, органические соединения. Например, азот, жидкий кислород.
Фарадей, изучая процесс распада ионов, задавался вопросом, можно ли «поймать» появляющиеся анионы и катионы. Как оказалось — вполне возможно. Для этого нужно просто создать окислительно-восстановительный процесс. В результате можно собрать на одной стороне катионы, а на другой анионы. Реакции диссоциации в электролите относятся к первичным процессам, а те, что протекают при восстановлении — вторичными.
Литература
1.Бахир В.М., Лиакумович А.Г., Кирпичников П.А., Спектор Л.Е., Мамаджанов У.Д. “Физическая природа явлений активации веществ”, Изв. АН УзССР. Сер.техн. наук, 1, 60-64 (1983).
2. Кульский Л. А. Очистка воды электрокоагуляцией / Л.А. Кульский, П.П. Строкач, В.А. Слипченко и др., Будiвельник, Kiев (1978), 112 с.
3. Липовецкий Я.М. Электрохимические способы очистки питьевых и сточных вод / Я.М. Липовецкий, Я.Д. Рапопорт, ЦБНТИ Минжилкомхоза РСФСР, Москва (1985), 56 с.
4. Кирпичников П. А., Бахир В. М., Гамер П.У., Добреньков Г.А., Лиакумович А.Г., Фридман Б.С., Агаджанян С.И. “О природе электрохимической активации сред”, Докл. АН СССР, 286(3), 663-666 (1986).
5. Бахир В.М.,Задорожний Ю.Г. Электрохимические реакторыРПЭ, Гиперокс, Москва (1991), 35 c.
6. Яковлев С.В. Технология электрохимической очистки воды / С.В. Яковлев, И.Г. Краснобородько, В.М. Рогов. Л.О. Стройиздат, Ленинград (1987), 312 с.
7. Бахир В.М. Современные технические электрохимические системы для обеззараживания, очистки и активирования воды. ВНИИИМТ, Москва (1999), 84 с.
8. Бахир В.М., Задорожний Ю.Г., Леонов Б.И., Паничева С.А., Прилуцкий В.И. Электрохимическая активация: очистка воды и получение полезных растворов, ВНИИИМТ, Москва (2001), 176 с.
9. Кульский Л.А. Справочник по свойствам, методам анализа и очистке воды: В 2-х частях. Часть 1 / Л.А. Кульский, И.Т. Гороновский, А.М. Когановский и др., Наукова думка, Киев (1980), 680 с.
10. Медриш Г.Л. Обеззараживание природных и сточных вод с использованием электролиза / Г.Л. Медриш, А.А. Тайшева, Д.Л. Басин., Стройиздат, Москва (1982), 80 с.
11. Воловник Г.И. Теоретические основы очистки воды / Г.И. Воловник, Л.Д. Терехов. Часть 1., Издательство ДВГУПС, Хабаровск (2000), 167 с.
12. Бахир В. М. Электрохимическая активация, ВНИИИ мед. техники, 2 часть, Москва (1992), 657 c.
13. Бабцова Н.Ф., Комаров И.Ф. Опыт использования установки СТЭЛ в хирургическом отделении. Второй международный симпозиум. Электрохимическая активация. Тез. докладов и краткие сообщения. ч.1 (1999), с. 131-132.
14. Леонов Б.И., Прилуцкий В.И., Бахир В.М. Физико-химические аспекты биологического действия электрохимически активированной воды, ВНИИИМТ, Москва (1999), 244 с.
15. Бахир В.М. Теоретические аспекты электрохимической активации. / Второй международный симпозиум. Электрохимическая активация. Тез. докладов и краткие сообщения, ч.1 (1999), с.39-49.
16. Торопков В.В., Альтшуль Э.Б., Торопкова Е.В. Токсикологическая характеристика препарата католит / Третий Международный симпозиум «Электрохимическая активация»// Доклады и краткие сообщения, Москва (2001), с.57-62.
17. Леонов Б.И., Бахир В.М., Вторенко В.И. Электрохимическая активация в практической медицине / Второй Международный симпозиум «Электрохимическая активация»// Тез. докл. и краткие сообщения, ч.1, Москва (1999), с.15-23.
18. Торопков В.В.Альтшуль Э.Б., Пересыпкин О.И. Фармакологическая эффективность действия анолитов АН и АНК на слизистые оболочки ротовой полости / Второй Международный симпозиум «Электрохимическая активация»// Тез. докл. и краткие сообщения, ч.1, Москва (1999), с. 93-95.
19. Прилуцкий В.И., Бахир В.М. Электрохимически активированная вода: аномальные свойства, механизм биологического действия, ВНИИИМТ, Москва (1997), 228 с.
20. Паничева С.А. Новые технологии дезинфекции и стерилизации сложных изделий медицинского назначения, ВНИИИМТ, Москва (1998), 122 с.
Что произошло
Молекулы воды H2O очень устойчивы. Чтобы разрушить их, потребуется много энергии. Под действием электричества из батареек крепкие связи молекул воды разрываются. Так выделяется кислород O2 и водород H2 , которые затем улетают из раствора.
Смесь газов H2 и O2 (в соотношении 2 к 1) называется гремучей неспроста: ее можно легко зажечь, например, пламенем свечи. При этом происходит реакция с характерным хлопком и выбросом энергии . Удивительно, но это та самая энергия, которая в начале потребовалась для разрушения молекул воды. Просто теперь она выделяется в иной форме. Так снова образуется вода H2O .
Эту реакцию обычно проводят ради получения не воды, а энергии. Ее используют в качестве движущей силы ракетных двигателей
Только такую реакцию очень важно тщательно контролировать: она может быть очень опасной. В 1937 году потерпел крушение дирижабль «Гинденбург» из-за этой реакции
Он был наполнен водородом в объеме 200 000 м3, который прореагировал с кислородом воздуха, и дирижабль сгорел дотла. При этом образовалось более 150 тонн воды!
Почему содержимое баночки загорается?
Химическая формула молекулы воды выглядит как H2O. Это означает, что она состоит из двух атомов водорода и одного атома кислорода. Баночка как раз наполнена смесью из газообразного водорода и кислорода в отношении 2 к 1, полученной электролизом воды.
Когда эта смесь воспламеняется, тут же запускается реакция образования воды, которая сопровождается характерным хлопком.
Узнать больше
Реакция образования воды выглядит довольно просто:
2H2 + O2 → H2O
Однако все немного сложнее. Это окислительно-восстановительная реакция, в которой кислород является окислителем (забирает электроны водорода), а водород — восстановителем (отдает свои электроны кислороду):
O2o + 4e− → 2O2−
H2o — 2e− → 2H+
Реакция протекает весьма интенсивно, особенно когда кислород смешивается с водородом в соотношении 1:2, как это было в нашем эксперименте. Это связано с тем, что водяной пар, который мы получили, содержит один атом кислорода и два атома водорода, то есть соотношение как раз равно 1:2.
Как кислород и водород оказались в баночке?
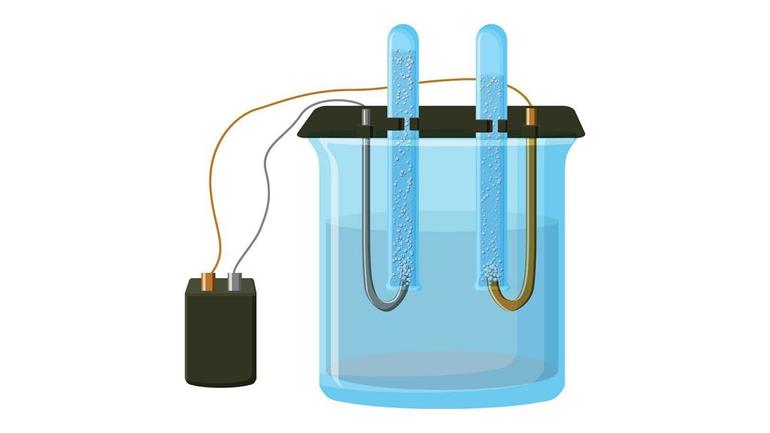
Эти газы появились там благодаря электролизу — процессу, в котором вода под действием электричества разлагается на кислород и водород. В ходе электролиза кислород и водород переходят в газообразную форму в соотношении 1:2. Образуется гремучая смесь, которая и гасит свечу.
Как протекает электролиз?
Для этого процесса нужна щелочная среда, поэтому мы добавляем гидроксид натрия NaOH. Теперь вода может расщепляться на ионы в жидком состоянии:
H2O → H+ + OH−
Щелочная среда повышает концентрацию гидроксид-ионов OH− . Электролизёр (устройство для электролиза воды) имеет положительно заряженный анод , который притягивает анионы, и отрицательно заряженный катод , который привлекает катионы. Таким образом, катионы H+ мигрируют к катоду, а анионы OH− — к аноду.
Тогда ионы H+ берут электроны с катода и превращаются в водород H2 , а гидроксидные ионы OH− отдают свои электроны аноду и превращаются в кислород O2 .
В нашем эксперименте электролизёром выступает штекер RCA, в котором металлическое кольцо служит катодом, а штифт — анодом. Однако полюса можно менять, соединяя провода вилки и держателя батареи наоборот — это не повлияет на эксперимент.
Что такое штекер RCA?
Штекер RCA когда-то широко использовался для аудио- и видеосистем. Он может подключить, например, видеопроигрыватель к телевизору. Он по-прежнему используется для некоторого визуального оборудования, но уже не так массово. Он состоит из двух металлических частей, внешнего кольца, штифта и пластмассового изолирующего кольца между ними. Отдельные провода подключаются к каждой металлической части: короткие провода — к металлическому кольцу, а длинные — к штифту.
Водородный двигатель своими руками
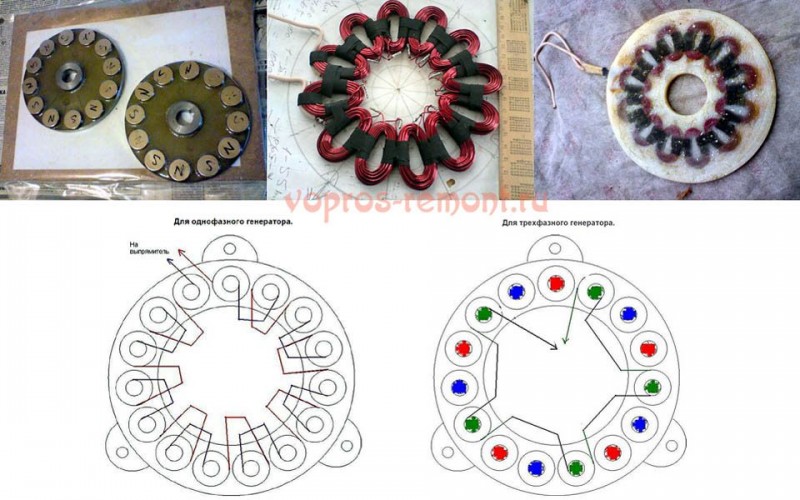
Генератор
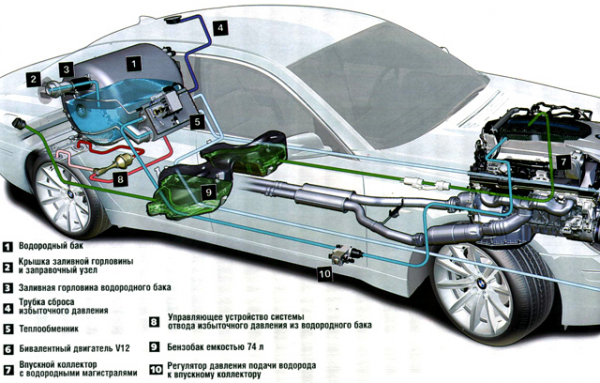
Для того, чтобы сконструировать мощный автомобильный двигатель, работающий на водородном топливе, необходимо начать свою работу с генератора. Емкость, которая является полностью герметичной, с жидкостью и погруженными в неё электродами, и есть тем самым простым генератором. Для функционирования данного приспособления необходим источник с напряжением в 12 В.
Смесь водорода с кислородом отводится через специальный штуцер, который расположен на крышке самодельной конструкции. Это является основой работы генератора для мотора на водородном топливе.

Полноценная работа системы не возможна без специального накопителя и батареи. Под корпус можно взять водопроводный фильтр или же приобрести специальную установку. У специальной установки есть одно весомое преимущество, они оборудованы электродами, обладающими высокой производительностью.
В образовании нужного газа нет никаких больших трудностей – все достаточно просто. Трудности касаются количества газа, достаточно тяжело произвести его в нужном количестве. Увеличить степень эффективности можно за счет медных электродов. Также используют электроды из нержавейки, но они менее продуктивны.
Еще понадобится электронный блок, который стабилизирует подачу тока, поскольку он имеет разную силу. Для нормальных условий реакции необходим постоянный уровень воды в емкости. Поэтому стоит сделать автоматическую подачу жидкости. Благодаря интенсивности реакции электролиза соль выделяется в достаточном количестве.
Важно! Необходимо отметить, что протекание реакции электролиза возможно только в дистиллированной воде.

Для мотора на водородном топливе готовится специальная вода в количестве 10 литров, в которую добавляется гидроксид в количестве 50 грамм.
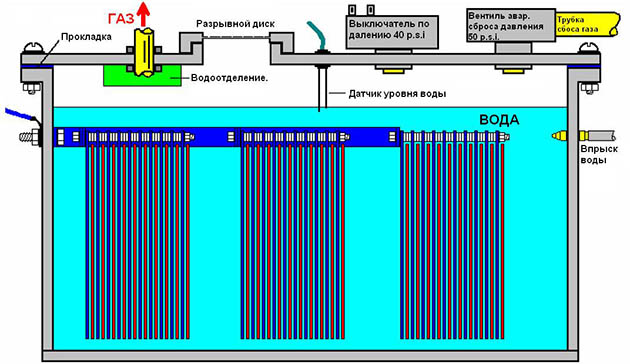
Устройство водородного двигателя
Для работы мотора на водородном топливе понадобятся запасные емкости и отводная система. Кроме этого нужно вмонтировать специальный прибор контроля уровня жидкости.
Совет! Чтобы избежать ложной реакции нужно установить его внутри корпуса. Датчик будет подавать командные импульсы, которые обеспечат автоматическую подпитку.
Важное значение имеет датчик давления. Его включение происходит на пометке в 40 psi
В момент, когда давление повысится и достигнет пометки 45 psi, происходит отключение подкачки. В случае превышения давления выше пометки 50 psi, срабатывает установленный предохранитель.
Для установки на автомобильный двигатель с водородным типом топлива используют предохранитель, состоящий из вентиля, предназначенного для аварийной откачки и разрывного диска. Активизация разрывного диска происходит в случае, когда давление достигнет показателя 60 psi. Отвод тепла осуществляется при помощи холодной свечи.
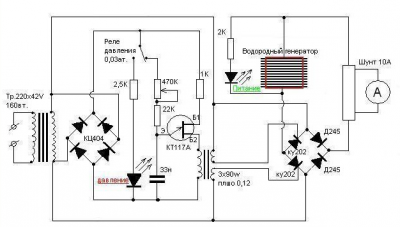
Электрическая часть
Регуляцию частоты и ширины импульса в моторе на водородном топливе осуществляет счетчик, работающий по принципу генератора импульсного плана.
Плата мотора оснащается двумя импульсными датчиками. Ближний должен быть оборудован крупным конденсатором. Робота второго начинается при помощи выхода с контакта № 3.
Располагающийся на счетчике последний выход соединен с коммутаторами, имеющими сопротивление 220 и 820 Ом. Увеличение тока до необходимого уровня происходит за счет транзистора. Вся ответственность защиты лежит на диоде 1N4007. Что позволяет придать процессам системы стабильность.
Что такое электролиз?
Электролиз представляет собой комплекс специфических процессов в системе электродов и электролита при протекании по ней постоянного электрического тока. Его механизм основывается на возникновении ионного тока. Электролит – это проводник 2-го типа (ионная проводимость), в котором происходит электролитическая диссоциация. Она связана с разложением на ионы с положительным (катион) и отрицательным (анион) зарядом.
Электролизная система обязательно содержит положительный (анод) и отрицательный (катод) электрод. При подаче постоянного электрического тока катионы начинают двигаться к катоду, а анионы – к аноду. Катионами в основном являются ионы металлов и водород, а анионами – кислород, хлор. На катоде катионы присоединяют к себе избыточные электроны, что обеспечивает протекание восстановительной реакции Men+ + ne → Me (где n – валентность металла). На аноде, наоборот, электрон отдается из аниона с протеканием окислительной реакции.
Таким образом, в системе обеспечивается окислительно-восстановительный процесс
Важно учитывать, что для его протекания необходима соответствующая энергия. Ее должен обеспечить внешний источник тока
Методы
Фундаментальная демонстрация
Два ведет, бегущий от терминалов батареи, помещены в чашку воды с количеством электролита, чтобы установить проводимость в решении. Используя NaCl (столовая соль) в решении для электролита приводит к хлоргазу, а не кислороду из-за конкурирующей полуреакции. С правильными электродами и правильным электролитом, такими как пищевая сода, водород и кислородные газы будут течь от противоположно заряженных электродов. Кислород соберется в положительно заряженном электроде (анод), и водород соберется в отрицательно заряженном электроде (катод)
Обратите внимание на то, что водород положительно заряжен в молекуле HO, таким образом, это заканчивается в отрицательном электроде. (И наоборот для кислорода.)
Обратите внимание на то, что водный раствор воды с ионами хлорида будет, когда электролизуется, любой результат или в, О, если концентрация Статьи будет низкой, ИЛИ в хлоргазе, предпочтительно освобождаемом от обязательств, если концентрация Статьи больше, чем 25% массой в решении
Хофман voltameter
Хофман voltameter часто используется в качестве небольшого гальванического элемента. Это состоит из трех вертикальных цилиндров, к которым присоединяются. Внутренний цилиндр открыт наверху, чтобы позволить добавление воды и электролита. Платиновый электрод помещен у основания каждого из двух цилиндров стороны, связанных с положительными и отрицательными терминалами источника электричества. Когда током управляют через Хофмана voltameter, газообразные кислородные формы в аноде (положительный) и газообразный водород в (отрицательном) катоде. Каждый газ перемещает воду и собирается наверху двух внешних труб, где это может быть снято с задвижкой.
Промышленный электролиз
Много промышленных клеток электролиза очень подобны Хофману voltameters со сложными платиновыми пластинами или сотами как электроды. Обычно единственный водород времени преднамеренно произведен из электролиза, для отдельного момента применения использования того, которое имеет место с oxyhydrogen факелами или когда чрезвычайно высокая водородная чистота или кислород желаемы. Подавляющее большинство водорода произведено из углеводородов и в результате содержит незначительные количества угарного газа среди других примесей. Примесь угарного газа может быть вредна для различных систем включая многие топливные элементы.
Электролиз высокого давления
Электролиз высокого давления — электролиз воды со сжатой водородной продукцией вокруг Бара 120-200 (1740-2900 фунтов на квадратный дюйм). Герметизируя водород в electrolyser от необходимости во внешнем водородном компрессоре избавляют, среднее потребление энергии для внутреннего сжатия составляет приблизительно 3%.
Высокотемпературный электролиз
Высокотемпературный электролиз (также HTE или паровой электролиз) является методом, в настоящее время исследуемым для водного электролиза с тепловым двигателем. Электролиз высокой температуры может быть предпочтителен для традиционного электролиза комнатной температуры, потому что часть энергии поставляется как высокая температура, которая является более дешевой, чем электричество, и потому что реакция электролиза более эффективна при более высоких температурах.
Заключение
Электрохимическая обработка воды обладает рядом преимуществ по сравнению с альтернативными механическими, химическими и биологическими методами водообработки и водоочиски. Эти преимущества заключаются в эффективности, устойчивости, контролируемости и удобном автоматическом регулировании процессов, а также простоте конструкции аппаратуры. Установки для электрохимической очистки воды компактны, имеют высокий уровень безотказности, требуют простой эксплуатации и могут быть полностью автоматизированы. С другой стороны, при электрохимической обработке воды возрастает энергопотребление, а в случае применения растворимых анодов расходуется тонколистовая сталь. Поэтому электрохимическая обработка обычно оказывается более выгодной для установок малой производительности (до 10-20 м3/час). В многоступенчатых схемах улучшения качества воды электрохимическая обработка может удобно сочетаться с другими методами водоподготовки.