Продукт горения: классификация, виды, описание
Содержание:
Факторы, влияющие на температуру горения
Максимальная температура горения древесины зависит от породы и может быть достигнута при следующих условиях:
- количество содержания влаги — не больше 20%;
- для горения используется замкнутое пространство;
- доступность кислорода в необходимом объеме.
Возможно сжигание и свежих дров, имеющих влажность от 40 до 60%, при этом:
- сырые дрова воспламеняются только в хорошо растопленной печи;
- теплоотдача понизится на 20–40%;
- произойдет увеличение расхода дров, примерно в два раза;
- на стенах печи и дымохода осядет сажа.
Результативность горения будет значительно снижена из-за необходимости повышенной температуры, идущей на испарение воды и сжигание смолы у хвойных пород. В идеальных условиях самая высокая температура горения у бука и ясеня, а самая низкая – у тополя. Бук, лиственница дуб и граб относятся к ценным породам древесины и в качестве топлива не используются. В бытовых условиях для горения древесины в печах используют березу и хвойные породы деревьев, считая, что они дают наибольшую температуру при горении.
Какие дрова горят жарче?
Как уже упоминалось, дрова являются одним из самых используемых видов топлива для обогрева домов, находящихся за пределами города. Учитывая, что все дрова горят при разной температуре, надо выбрать те, которые лучше. Главным условием для горения дров является наличие кислорода, а это в значительной степени зависит от конструкции печи. Кроме того, у каждой древесины свой химический состав и плотность. Чем плотнее дерево, тем больше от него теплоотдача. Особое значение для большей теплоотдачи древесины при горении? кроме плотности и наличия кислорода, имеет влажность дров.
Сухие горят лучше и выделяют больше тепла, чем сырые дрова. Поэтому после распила их складывают в поленницы и просушивают под навесом в течение года. Каждый, кому доводилось топить печь дровами, замечал, что одни из них горят ярко, выделяя много тепла, а другие тлеют и мало нагревают печь. Все, оказывается, зависит от жаропроизводительности дров. По этому показателю самыми подходящими породами для горения в печах являются береза, сосна и осина.
Машины на дровах
В Советском Союзе в начале 1920-х годов газогенераторные грузовики использовались очень широко. В те годы у нас в стране даже проводились конкурсные испытания таких автомобилей.
Первым газогенераторный двигатель на машину у нас в СССР установил профессор В. С. Наумов в 1927 г. В 1928 г. конструированием таких автомобилей начал заниматься в России Научный автотракторный институт. Специалистами этого учреждения тогда были проведены опыты с иностранными машинами «Имберт-Дитрих» и «Пип».
Первый построенный у нас в стране газогенератор НАТИ-1 работал на обычных дровах. В 1932 г. была создана также установка НАТИ-3, предназначенная для моторного катера. В то же время в России появился и первый автомобильный газогенератор, созданный при поддержке общества «Автодор». Название он получил «Автодор-1». Еще позднее в СССР было разработано несколько более совершенных установок этого типа. Состав пиролизного газа, получаемого с их использованием, был на самом деле очень качественным. Автомобили, работающие на этом топливе, отличались надежностью, превосходными эксплуатационными качествами и долгим сроком службы.
Во время ВОВ на фронтах и в тылу в СССР активно использовались газогенераторные грузовики ЗИС-5 и ГАЗ-АА. К концу войны в стране эксплуатировалось уже около 200 тыс. автомобилей с двигателями на пиролизном газе.
Конечно же, использование такого топлива было вызвано в первую очередь нехваткой в стране в те времена нефтепродуктов. Однако не стоит думать, что пиролизный газ применялся только из-за дефицита бюджета государства. Такое топливо в те времена считалось достаточно эффективным и перспективным и использовалось не только в России. К примеру, в 20-30 годы прошлого века автотехника на пиролизе получила широкое распространение в таких странах, как Франция, Германия, Великобритания, Финляндия, Швеция. Также машины, работающие на таком газе, широко использовались и в некоторых странах Азии. К примеру, автомобили этого типа с успехом эксплуатировались в те времена в Китае, Японии и Индии.
Гремучая смесь
Гремучая смесь ( смесь двух объемов водорода и одного объема кислорода) при комнатной температуре не реагирует. Если нагреть ее хотя бы в одном месте до 700 С, процесс взаимодействия начнется бурно и окончится мгновенно со взрывом.
Гремучая смесь находится в закрытом сосуде при стандартных условиях.
Образование гремучей смеси может иметь место также при неправильном пуске камеры розжига, куда, как известно, подаются горючий ( преимущественно водяной) газ и воздух.
|
Полуостров воспламенения при реакции окисления. |
Воспламенение гремучей смеси происходит только при условиях, соответствующих точкам внутри заштрихованной площади, которая и называется полуостровом воспламенения. Вне пределов полуострова воспламенения не происходит — реакция идет медленно или даже не идет вовсе.
|
Схема циркуляции водорода в турбогенераторе серии ТВ2 с вертикальным расположением газоохладителей. |
Образование гремучей смеси в генераторе возможно лишь в процессе заполнения его водородом. Чтобы это предотвратить, применяют промежуточное заполнение машины углекислым газом. Так как статор выполняют взрывостойким и газоплотным, то практически без конструктивных изменений можно применять водород с повышенным давлением. При этом его плотность увеличивается и, следовательно, возрастает объемная теплоемкость. Коэффициент теплоотдачи с поверхности также возрастает, но несколько слабее, чем по линейной зависимости.
Что такое гремучая смесь и в чем заключается ее опасность.
Вероятность образования гремучей смеси увеличивается при остановке и пуске доменной печи. Из остановленной печи прекращается выход газа, а оставшийся в сети газ, уменьшаясь в объеме при охлаждении, создает разрежение, вследствие чего возможно подсасывание воздуха и образование взрывоопасной смеси.
Устройство сжигания гремучей смеси выводит из потока смесь кислорода и водорода, так как при их концентрации более 4 % она взрывоопасна.
Найденные для гремучей смеси закономерности и факты затем подтверждены и обобщены на реакциях горения углеводородов, методом фиксации промежуточных перекисей и альдегидов при низких температурах.
|
Изменение скорости реакции № в процессе реагирования. |
Например, гремучую смесь водорода с кислородом при комнатной температуре ( и при атмосферном давлении) можно хранить в сосуде сколько угодно долго, не опасаясь, что произойдет горение ( взрыв), так как при такой температуре реакция окисления водорода идет чрезвычайно медленно.
На электролизных установках гремучая смесь может образоваться при понижении уровня электролита в электролизере и оголении диафрагм, когда водород через отверстия катодного листа и поры диафрагмы диффундирует в анодное пространство, или при значительном превышении давления в катодном пространстве по сравнению с анодным.
Примером может служить гремучая смесь: 2H2 — f — O2, находящаяся при комнатной температуре в ложном равновесии.
Котлы
С древних времен человек отапливал свои жилища с использованием обычных печей, функционирующих на дровах и на угле. Позднее дома начали оборудовать современными твердотопливными котлами, функционирующими на том же виде топлива. Такие агрегаты используются для обогрева жилищ и в наше время. Стоят они недорого и для их монтажа не нужно получать разрешения в разного рода инстанциях. Однако у обычных твердотопливных котлов есть один довольно-таки серьезный недостаток. Топливо они потребляют крайне неэкономично. В камерах таких агрегатов остается много остатков сгорания. К тому же часть тепла, вырабатываемого таким оборудованием, попросту вылетает «в трубу» вместе с дымом.
Инженеры, решившие исправить этот минус твердотопливных котлов, и придумали в конечном итоге пиролизные нагревательные экономичные и удобные в эксплуатации агрегаты. В таких котлах есть, помимо всего прочего, дополнительные камеры, в которых происходит дожиг пиролизного газа.
Реакция в агрегатах этой разновидности протекает при сильном дефиците кислорода (15 %). Древесина или любое другое топливо в оборудовании этого типа распадается на газы и небольшое количество неорганических остатков. У пиролизных газов температура горения в камере дожига может доходить до 110-1200 °С.
Выхлопные газы
Большинство современных машин работает на двигателе внутреннего сгорания, то есть для движения используется энергия, получающаяся при сгорании топлива. Чаще всего это бензин и другие нефтепродукты. Но при выгорании в атмосферу выбрасывается большое количество отходов. Это и есть выхлопные газы. Они высвобождаются в атмосферу в виде дыма из выхлопных труб автомобиля.
Большую часть от их объема занимает азот, а также вода, углекислота. Но также выбрасываются и токсичные соединения: угарный газ, оксиды азота, не сгоревшие углеводороды, а также сажа и бензпирен. Последние два являются канцерогенами, то есть повышают риск развития рака.
Какие продукты могут использоваться
Пиролизные котлы в домах могут работать на обычных дровах или специальных паллетах, к примеру, из опилок или прессованной стружки. Также подвергаться пиролизу могут и разного рода бытовые и промышленные отходы. Сжигается подобным образом, к примеру, резина, старые автомобильные покрышки, пластиковые, отслужившие свое, вещи и пр. В данном случае пиролиз позволяет не только получить определенную долю тепла, но и сохранить в чистоте окружающую среду. Ведь, как известно, пластик не разлагается в земле долгое время. Разного рода же нефтесодержащие материалы очень сильно загрязняют как сами грунты, так и водоемы.
Также сжигаться подобным образом могут:
-
бумага, картон, текстиль;
-
метан;
-
углеводороды;
-
торф;
-
нетоварная древесина (в том числе и с химической пропиткой);
-
солома, листва, скорлупа орехов, сорняки.
Помимо этого, перерабатываться посредством реакции пиролиза могут остатки лакокрасочной продукции, масла и пр. Это также позволяет сохранить в чистоте окружающую среду.

Сернистый газ, сероводород
Сернистый газ также является оксидом, но на этот раз серы – SO2. Он имеет большое количество названий: двуокись серы, диоксид серы, сернистый ангидрид, оксид серы (IV). Представляет собой этот продукт горения бесцветный газ, с резким запахом подожженной спички (он при ее возгорании и выделяется). Выделяется ангидрид при горении серы, серосодержащих органических и неорганических соединений, например, сероводорода (Н2S).
При попадании на слизистую глаз, носа или рта человека двуокись легко реагирует с водой, образуя сернистую кислоту, которая легко разлагается обратно, но при этом успевает раздражать рецепторы, спровоцировать воспалительные процессы дыхательных путей: H2O+SO2⇆H2SO3. Этим обусловлена токсичность продукта горения серы. Сернистый газ, так же как и угарный, может гореть – окисляться до SO3. Но происходит это при очень высокой температуре. Данное свойство используется при производстве серной кислоты на заводе, так как SO3 реагирует с водой, образует H2SO4.
А вот сероводород выделяется при термическом разложении некоторых соединений. Этот газ также ядовит, имеет характерный запах тухлых яиц.
Описание процесса горения
В процессе горения древесины отмечается несколько этапов:
- Разогрев – происходит при температуре не менее 150 градусов по Цельсию и в присутствии наружного источника огня.
- Воспламенение – необходимая температура от 450 до 620 градусов по Цельсию в зависимости от влажности и плотности древесины, а также от формы и количества дров.
- Горение – состоит из двух фаз: пламенной и тления. Некоторое время оба вида протекают одновременно. После прекращения образования газов горит (тлеет) только уголь.
- Затухание – возникает при прекращении подачи кислорода или когда заканчивается топливо.

Плотная древесина горит медленнее, чем менее плотная вследствие того, что имеет большую теплопроводность. При горении сырых дров много тепла затрачивается на испарение влаги, поэтому они горят медленнее сухих дров. Горение древесины — это физическое или химическое явление? Этот вопрос имеет практическое значение, и от правильной его интерпретации будут зависеть условия максимальной теплоотдачи и длительности горения. С одной стороны, это химическое явление: при горении дров происходит химическая реакция и образуются новые вещества – оксиды, выделяется тепло и свет. С другой, – физическое: во время процесса происходит увеличение кинетической энергии молекул. В итоге получается, что процесс горения древесины – это сложное физико-химическое явление. Знакомство с ним поможет правильно подобрать породы древесины, чтобы обеспечить себя длительным и устойчивым источником тепла.
Условия протекания химических реакций
Необходимое и главное условие для протекания большинства реакций между различными веществами — это их соприкосновение. Для обеспечения лучшего контакта вещества измельчают, переводят в газообразное состояние. Многие вещества лучше реагируют друг с другом, если они растворены в воде.
Во многих случаях этого недостаточно, поэтому реагирующие вещества нагревают. Деревянная лучинка, смесь железа и серы, медь могут долгое время сохраняться при комнатной температуре, реакции начинаются только при их нагревании.
Мало знать, как начать химическую реакцию, надо еще знать, при каких условиях она будет протекать дальше. Почему необходимо все время нагревать сахар, чтобы добиться его полного сгорания, а деревянную лучинку зажигают один раз и она продолжает гореть?
Если при образовании новых веществ выделяется много теплоты, то ее бывает достаточно, чтобы нагревались новые порции вещества и реакция продолжалась. Во многих случаях реакции, начавшись, продолжаются за счет теплоты, выделяемой в этих реакциях, не требуя дополнительной энергии. Примером является горение угля. Другие реакции, например разложение сахара, требуют постоянной затраты энергии на ее продолжение.
В некоторых случаях для начала химического процесса необходимо освещение. Одной из таких реакций, требующих постоянного освещения, является известная вам реакция фотосинтеза.
Таким образом, окружающий нас мир состоит из множества веществ, которые вступают в различные химические реакции. Изучая химические реакции, человек познает сущность процессов, протекающих в живой и неживой природе. Полученные знания помогают более эффективно использовать вещества для получения больших урожаев, выращивания животных, борьбы с различными болезнями. Человечество учится бережно и грамотно относиться к окружающему нас миру.
Краткие выводы урока:
- Химические реакции — это явления превращения одних веществ в другие.
- О протекании химических реакций судят по выделению газа, выпадению или исчезновению осадка, изменению цвета, появлению запаха, поглощению или выделению теплоты и излучению света.
- Необходимым условием протекания большинства химических реакций является соприкосновение реагирующих веществ.
Надеюсь урок 10 «Признаки химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Химические свойства
Кислород является химически активным веществом. Он способен вступать в реакции с множеством других веществ, однако для протекания большинства этих реакций необходима более высокая, чем комнатная, температура. При нагревании кислород реагирует с неметаллами и металлами.
Если стеклянную колбу наполнить кислородом и внести в нее ложечку с горящей серой, то сера вспыхивает с образованием яркого пламени и быстро сгорает (рис. 80).
Химическую реакцию, протекающую в этом случае, можно описать следующим уравнением:
В результате реакции образуется вещество SO2, которое называется сернистым газом. Сернистый газ имеет резкий запах, который вы ощущаете при зажигании обычной спички. Это говорит о том, что в состав головки спички входит сера, при горении которой и образуется сернистый газ.
Подожженный красный фосфор в колбе с кислородом вспыхивает еще ярче и быстро сгорает, образуя густой белый дым (рис. 81).
При этом протекает химическая реакция:
Белый дым состоит из маленьких твердых частиц продукта реакции — P2O5.
Если в колбу с кислородом внести тлеющий уголек, состоящий в основном из углерода, то он также вспыхивает и сгорает ярким пламенем (рис. 82).
Протекающую химическую реакцию можно представить следующим уравнением:
Продуктом реакции является CO2, или углекислый газ, с которым вы уже знакомы. Доказать образование углекислого газа можно, добавив в колбу немного известковой воды. Помутнение свидетельствует о присутствии CO2 в колбе.
Возгорание уголька можно использовать для отличия кислорода от других газов. Если в сосуд (колбу, пробирку) с газом внести тлеющий уголек и он вспыхнет, то это указывает на наличие в сосуде кислорода.
Кроме неметаллов, с кислородом реагируют и многие металлы. Внесем в колбу с кислородом раскаленную стальную проволоку, состоящую в основном из железа. Проволока начинает ярко светиться и разбрасывать в разные стороны раскаленные искры, как при горении бенгальского огня (рис. 83).
При этом протекает следующая химическая реакция:
В результате реакции образуется вещество Fe3O4 (железная окалина). В состав формульной единицы этого вещества входят три атома железа, причем один из них имеет валентность II, а два других атома имеют валентность III. Поэтому формулу этого вещества можно представить в виде FeO * Fe2O3.
Реакцию железа с кислородом используют для резки стальных изделий. Для этого определенный участок детали сначала нагревают с помощью кислородногазовой горелки. Затем направляют на нагретое место струю чистого кислорода, для чего перекрывают кран поступления горючего газа в горелку. Нагретое до высокой температуры железо вступает в химическую реакцию с кислородом и превращается в окалину. Так можно разрезать очень толстые железные детали.
Для чего используют термическое разложение
Сфера применения пиролитических процессов довольно широка:
- Производство пропилена и этилена для химической промышленности путем переработки жидкого углеводородного сырья (нефти).
- Получение древесного угля методом бескислородного разложения отходов деревообработки.
- Тот же технологический процесс, но с ограниченной подачей воздуха позволяет вырабатывать из дерева горючий синтез-газ – смесь метана, водорода, угарного газа и нейтрального азота.
- Пиролиз угля – бурого и каменного – целое направление переработки. Получаемые соединения – синтетический бензин, кокс, аммиак, каменноугольная смола. Из последней добывают толуол, бензол, нафталин и различные фенолы, использующиеся в химической промышленности.
- Новые разработки – коммерческая утилизация твердых бытовых отходов, автомобильных шин, пластмасс, органики.
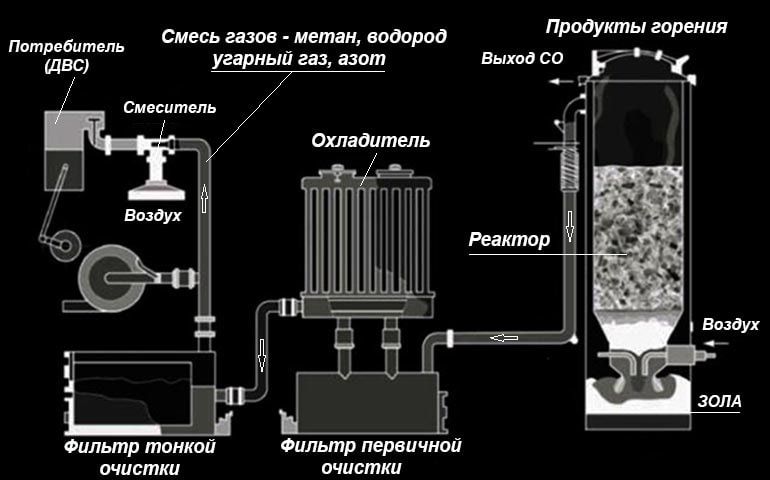
Для термического разложения в промышленности используются пиролизные печи и разнообразные реакторы. Выше на схеме показана газогенераторная установка, перерабатывающая деревянные отходы и опил в газообразное топливо. Главную роль здесь играет реактор прямого процесса сухой перегонки, где подготовленное сырье перерабатывается в синтез-газ путем медленного сжигания.
Важный нюанс. Перед загрузкой в пиролизную печку или газогенератор древесина всегда измельчается и просушивается до влажности 10% и менее.
В промышленной химии также используется технология быстрого пиролиза, когда реактор разогревается до температуры 700…900 °C в течение малого промежутка времени. Цель – увеличение производительности оборудования и ускорение переработки.
Watch this video on YouTube
Какой газ выделяется при горении?
Существует предположение, что одна из причин низкой продолжительности жизни первобытных людей (а она была в 2-3 раза меньше, чем у современного человека) — дым костров.
Но в те времена постоянный огонь был вынужденным средством для зашиты от холода, голода и диких животных. А мы в цивилизованных условиях создаем дополнительное токсическое воздействие на самих себя и окружающую среду, разводя опасные костры или сжигая все, что попадется под руку.
Может возникнуть вопрос: куда же девать отходы без костров? Ответ простой: синтетический бытовой хлам — в мусорные контейнеры, а все растительные остатки — в землю! Особенно это важно в нынешнем году, когда все и без того надышались гарью бушевавших пожаров. Нина Ефимова, кандидат с.-х
наук
Нина Ефимова, кандидат с.-х. наук
Вернуться в оглавление — Советы
Температура горения газа при разных режимах в газовой плите
Именно в нем горелки поджигают — на минимуме подачи топлива и еще меньшем притоке воздуха. Во-вторых, свободный приток вторичного воздуха может быть очень полезен в т.
По использованию воздуха эжекционные горелки делятся на:. В горелках с наддувом весь воздух, и первичный, и вторичный, подается в зону сгорания топлива принудительно.
Простейшая микрогорелка с наддувом для настольных спаечных, ювелирных и стекольных работ может быть сделана самостоятельно см. Зато именно горелки с наддувом позволяют реализовать все возможности управления режимом горения; согласно условиям использования они делятся на:. В однорежимных горелках режим сгорания топлива либо определяется раз навсегда конструктивно напр. Двухрежимные горелки работают, как правило, на полной или половинной мощности.
Переход с режима в режим осуществляется по ходу работы либо пользования. В модулируемых горелках подача топлива и воздуха плавно и непрерывно регулируется автоматикой, отрабатывающей по комплексу критически важных исходных параметров. Выходной параметр возможен один минимальный расход газа, наибольшая температура пламени или их может быть тоже несколько, напр.
Например, работа газовой духовки оценивается по следующим параметрам:. Для того чтобы проверить точно, с какой температурой работает газовая плита, необходимы элементарные знания по физике. То есть информация, которая касается закипания различных жидкостей.
К основным параметрам относятся:. Кипящая вода. Такой способ определения температуры горения пламени в газовой плите подойдет только для старых моделей. Так как новая и современная техника оборудована сверхчувствительными термометрами и специальными датчиками, которые измеряют температуру максимально точно
Важно: благодаря измерениям можно регулировать и корректировать работу бытового оборудования для кухни, устанавливая оптимальные значения, чтобы добиться идеального вкуса блюд
Горящая конфорка. Нагреватели водяные. Нагреватели электрические. Охладители водяные. Приточные установки компактные. Приточно-вытяжные установки с рекуперацией тепла. Фасонные изделия.
Схематическое изображение пламени газовой горелки
Хомуты для воздуховодов. Шина, уголки, крепеж.
Газовые горелки являются незаменимым помощником в хозяйстве, мастерских и производственных цехах, на пикнике и в турпоходах. Легкость и удобство применения давно передали ветвь первенства газовым приборам в сравнении с другими видами. При выборе горелки стоит учитывать сферу применения, необходимую мощность, а также максимальную температуру пламени. Последний фактор особенно важен при выполнении более тонких видов работ. Поэтому необходимо знать основные параметры, напрямую связанные с распределением температурного режима пламени газовой горелки.
Пламя газовых горелок благодаря давлению газа в условиях невесомости внешне также не отличается от горения в земных условиях. Тидеман Б. Химия горения. Материал из Википедии — свободной энциклопедии.