Формула газа
Содержание:
Применение
Где используется?

Интерес к такому альтернативному виду топлива, как водород проявляется все больше. Но первым разработчиком, который представил автомобиль, работающий на таком топливе, был концерн Toyota. Однако его внедорожник FCHV так и остался выставочным экземпляром, серийно его выпускать не стали. Интерес к водородным двигателям не пропал, поэтому многие производители продолжают вкладывать большие деньги на внедрение такого движка.
Гремучий газ, точнее, водород с подачей кислорода, используется для сварки и пайки металлов в сложных условиях, таких как тоннели и шахты, коллекторы и монтажные колодцы, когда места для размещения баллонов с углеводородами просто нет. Температура горения смеси равна примерно 2235 °C, а продукты горения абсолютно безопасны для здоровья человека. Нашла свое применение водородная горелка в ювелирном и зубопротезном деле, ей обрабатывают стеклянные изделия, пластины из дорогих металлов разной толщины и другое.

Об элементе
Водоро́д — первый элемент периодической системы элементов; обозначается символом H. Название представляет собой кальку с латинского: лат. Hydrogenium (от др.-греч. ὕδωρ — «вода» и γεννάω — «рождаю») — «порождающий воду». Широко распространён в природе.
Три изотопа водорода имеют собственные названия: 1H — протий (Н), 2H — дейтерий (D) и 3H — тритий (радиоактивен) (T).
Простое вещество водород — H2 — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и ряде металлов: железе, никеле, палладии, титане, платине.
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Прямо указывал на выделение его и Михаил Васильевич Ломоносов, но уже определённо сознавая, что это не флогистон. Английский физик и химик Генри Кавендиш в 1766 годуисследовал этот газ и назвал его «горючим воздухом». При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона помешала ему сделать правильные выводы. Французский химик Антуан Лавуазье совместно с инженером Жаном Мёнье, используя специальные газометры, в 1783 г. осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Таким образом, он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
А. Л. Лавуазье дал водороду название hydrogène (от др.-греч. ὕδωρ — «вода» и γεννάω — «рождаю») — «рождающий воду».
В 1801 году последователь А. Л. Лавуазье академик В. М. Севергин называл его «водотворное вещество», он писал:
Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году — по аналогии с «кислородом» М. В. Ломоносова.
Физические свойства
Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Поэтому, например, мыльные пузыри, наполненные водородом, на воздухе стремятся вверх. Чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н. у.), температура кипения −252,76 °C, удельная теплота сгорания 120,9·106 Дж/кг, малорастворим в воде — 18,8 мл/л.
Химические свойства
Молекулы водорода достаточно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия.
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например, с кальцием, образуя гидрид кальция:
и с единственным неметаллом — фтором, образуя фтороводород:
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например, при освещении.
Он может «отнимать» кислород от некоторых оксидов.
Записанное уравнение отражает восстановительные свойства водорода.
С галогенами образует галогеноводороды: реакция протекает со взрывом в темноте и при любой температуре, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании.
Основная идея
Такое устройство вполне можно изготовить своими руками и использовать, к слову не только с целью отопления дома, но и, к примеру, для газорезки металла. Действие его заключается в процессе разложения воды в электролизере, полезным результатом которого и является газ Брауна, а побочным – водяной пар. Какие же отличительные черты можно выделить у этого оригинального способа отопления дома по сравнению с традиционными системами? Они следующие:
- Очевидно, что вода на нашей планете дефицитным соединением не является, распространена повсеместно, а значит, как сырье для получения энергии будет сверхдешевым и практически неисчерпаемым материалом;
- Еще более упрочняющим позиции первого утверждения выступает то обстоятельство, что побочным продуктом работы электролизера является водяной пар, после образования конденсата вновь становящийся жидкостью, т. е. вода рециркулирует, и это позволяет говорить о возобновляемости данного исходного материала;
- В виду отсутствия каких бы то ни было побочных продуктов работы электролизера, за исключением упомянутого водяного пара, применение данного изделия с целью последующего обогрева дома совершенно безвредно для человека и природы, т. е. является экологичным;
- Приятным дополнением выступает автоматическое поддержание достаточного уровня влажности в помещении за счет все того же выделения водяного пара, что не только предохраняет воздух от пересушивания, но и улучшает его характеристики теплопередачи.
Таким образом, идея использовать генератор газа Брауна в системах отопления во всех отношениях превосходная, но на пути повсеместного ее внедрения есть известные препятствия. Они сводятся к таким моментам:
- Основная загвоздка кроется в необходимости учета закона сохранения энергии, ведь для того, чтобы прибор вырабатывал газ, ему требуется электропитание, и если расходы на него будут сопоставимы с получаемым полезным теплом, то смысла в использовании подобных схем отопления становится немного. По поводу соотношения затрачиваемых ресурсов и полезной отдачи на выходе системы постоянно ведутся острые споры, но на данный момент нет общепринятого мнения по этому вопросу. Поскольку развитие технологий никогда не останавливается, то эта проблема рентабельности, может и не так быстро, как хотелось бы, но непременно будет устранена;
- Небеспочвенность скептических утверждений о нерентабельности и сомнительной эффективности систем отопления, использующих в качестве топлива газ Брауна, подтверждается как высокой стоимостью данного оборудования промышленного производства, так и дороговизной его в эксплуатации.
Однако, в сети Интернет можно обнаружить многочисленные советы по сборке производящих данный газ изделий, чертежи и схемы электролизеров, а также прочитать отзывы людей, которые с тем или иным успехом реализовали своими руками предложенные энтузиастами варианты или выработали собственные. Насколько можно использовать эту информацию в серьезных целях, судите сами, но поэкспериментировать, по меньшей мере, представляется интересным.
Сделаем такие же расчёты с трубкой – катодом
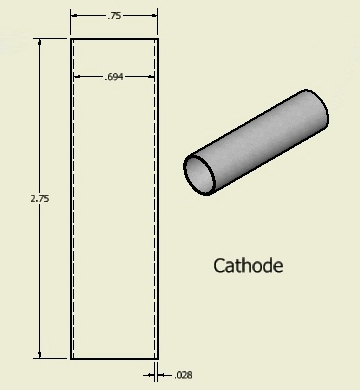
Длина активной зоны катода равна: Hк = 2,75 * 2,54 = 6,98 см
Внутренний диаметр катода равен: Dк = (0,75 – 0,056) * 2,54 = 1,76 см
Зная внутренний диаметр, найдем длину окружности катода: Lк = 1,76 * 3,14 = 5,53 см
Площадь активной поверхности катода равна: Sк = 5,53 * 6,98 = 38,57 см2
Общая площадь катодов установки равна: Sкобщ = 38,57 * 11 = 424,27 см2
Такую площадь имеет пластина размером приблизительно 20,5 х 20,5 см.
Логично, что площадь активной зоны катодов больше площади активной зоны анодов, ведь при разрыве молекулы воды на поверхности катодов выделяется две молекулы водорода, а на поверхности анодов выделяется одна молекула кислорода.
Сделаем допущения в пользу Мэйера на неравномерность выхода газа с пластин электролизёра и произведём расчёты выхода гремучего газа с одного квадратного сантиметра:
Сначала объединим площадь анода и катода: 278,5 см2 + 424,27 см2 = 702,77 см2
Сделаем расчёты необходимого выхода гремучего газа с одного квадратного сантиметра для двух вариантов:
1. С учётом только одного показателя — тепловой энергии;
2. С учётом «придуманного» комплексного энергетического коэффициента.
1. Разделим необходимое количество «гремучего газа» выделяемого в секунду на общую площадь электродов: 6380 мл / 702,77 = 9 миллилитров в секунду с одного квадратного сантиметра. А теперь представьте струю газа 9 миллилитров в секунду – это соответствует скорости потока воды, текущей из водопроводного крана тонкой струйкой. Представьте, что подобные струи текут с каждого квадратного сантиметра электродов. Такого представить невозможно. Тот, кто когда нибудь, видел, как работает электролизер, тот по результатам вычислений может сделать однозначное заключение: Учитывая общую маленькую площадь электродов этого электролизера – меньше листа формата А4, вне зависимости от его сверх КПД, этот электролизер не способен обеспечить кислородно-водородной смесью двигатель внутреннего сгорания даже имеющего всего один цилиндр, объёмом 0,2 литра.
2. Используя комплексный энергетический показатель, учитывающий тепловую энергию и скорость воспламенения, разделим необходимое количество «гремучего газа» выделяемого в секунду на общую площадь электродов: 394 мл / 702,77 = 0,56 миллилитров в секунду с одного квадратного сантиметра. Это тоже не совсем реальная цифра. Эту скорость можно сравнить с потоком жидкости через трубку применяемую в медицинских капельницах. Может у кого и получилось сделать такую производительность на единицу площади электродов электролизера, а я используя различные способы повышения эффективности, такой производительности никак не добился!
Думаю, что вы догадались, по моему мнению, электролизёр Resonant Cavity Стэнли Мэйера по причине малой площади пластин не способен обеспечить гремучим газом автомобиль, независимо от того, какой у этого электролизера КПД, даже если его КПД запределен. На единицу площади электродов не только не может вырабатываться столько газа, но вырабатываемый газ в маленьком промежутке между электродами, который выделяется с огромной скоростью будет просто мешать процессу электролиза.
Методика получения газа Брауна своими руками дома
ННО газ – настоящие ноу-хау в отоплении получил свое название благодаря физику Брауну. Он вывел новую формулу воду с определенными свойствами. Эти свойства подтвердили и последующие эксперименты.
Можно найти много информации о получении газа в домашних условиях. Достаточно самостоятельно соорудить специальную установку. Эффективность таких генераторов подтверждена численными положительными отзывами.
Части устройства для получения газа:
- Химическая представлена электролизером;
- Электрическая – источник питания.
Электролизер имеет простую конструкцию, состоящую из двух пластин или трубок, погруженных в воду. Материалом для трубок может служить нержавеющая сталь. При соединении приборов следует создать разные потенциалы. Так и будет разделяться вода, и выделяться необходимый газ.
Для работы электролизера потребуется ток. Выполнить это требования можно с помощью добавок в воду: сода, соль, калий. Но это неэффективно. Поэтому лучше сделать генератор импульсов.
Вода
Воду нельзя ничем заменить — этим она отличается практически от всех других веществ, которые встречаются на нашей планете. Воду может заменить только сама вода. Без воды нет жизни: ведь жизнь на Земле возникла тогда, когда на ней появилась вода. Жизнь зародилась в воде, поскольку она является естественным универсальным растворителем. Она растворяет, а значит, измельчает все необходимые питательные вещества и обеспечивает ими клетки живых организмов. А в результате измельчения резко возрастает скорость химических и биохимических реакций. Более того, без предварительного растворения невозможно протекание 99,5 % (199 из каждых 200) реакций! (См. также урок 5.1.)
Известно, что взрослый человек в сутки должен получать 2,5–3 л воды, столько же выводится из организма: т. е. в организме человека существует водный баланс. Если он нарушается, человек может просто погибнуть. Например, потеря человеком всего 1–2 % воды вызывает жажду, а 5 % — повышает температуру тела вследствие нарушения терморегуляции: возникает сердцебиение, возникают галлюцинации. При потере 10 % и более воды в организме возникают такие изменения, которые уже могут быть необратимы. Человек погибнет от обезвоживания.
Вода — уникальное вещество. Её температура кипения должна составлять –80 °C (!), однако равна +100 °C. Почему? Потому что между полярными молекулами воды образуются водородные связи:

Поэтому и лёд, и снег — рыхлые, занимают больший объём, чем жидкая вода. В результате лёд поднимается на поверхность воды и предохраняет обитателей водоёмов от вымерзания. Свежевыпавший снег содержит много воздуха и является прекрасным теплоизолятором. Если снег покрыл землю толстым слоем, то и животные и растения спасены от самых суровых морозов.
Кроме того, вода имеет высокую теплоёмкость и является своеобразным аккумулятором тепла. Поэтому на побережьях морей и океанов климат мягкий, а хорошо политые растения меньше страдают от заморозков, чем сухие.
Без воды в принципе невозможен гидролиз, химическая реакция, которая обязательно сопровождает усвоение белков, жиров и углеводов, которые являются обязательными компонентами нашей пищи. В результате гидролиза эти сложные органические вещества распадаются до низкомолекулярных веществ, которые, собственно, и усваиваются живым организмом (подробнее см. уроки 25–27). Процессы гидролиза были нами рассмотрены в уроке 6. Вода реагирует со многими металлами и неметаллами, оксидами, солями.
Задание 12.6. Составьте уравнения реакций:
- натрий + вода →
- хлор + вода →
- оксид кальция + вода →
- оксид серы (IV) + вода →
- хлорид цинка + вода →
- силикат натрия + вода →
Изменяется ли при этом реакция среды (рН)?
Вода является продуктом многих реакций. Например, в реакции нейтрализации и во многих ОВР обязательно образуется вода.
Задание 12.7. Составьте уравнения таких реакций.
Что такое водород?

Прежде чем рассматривать вопрос, какая температура сгорания водорода, необходимо вспомнить, что собой представляет это вещество.
Водород — это самый легкий химический элемент, состоящий всего из одного протона и одного электрона. При нормальных условиях (давление 1 атм., температура 0 oC) он присутствует в газообразном состоянии. Его молекула (H2) образована 2 атомами этого химического элемента. Водород является 3-м по распространенности элементом на нашей планете, и 1-м во Вселенной (около 90 % всей материи).
Водородный газ (H2) не имеет запаха, вкуса и цвета. Он не токсичен, однако, когда содержание его в атмосферном воздухе составляет несколько процентов, то человек может испытывать удушье, по причине недостатка кислорода.
Любопытно отметить, что хотя с химической точки зрения все молекула H2 идентичны, физические свойства их несколько отличаются. Дело все в ориентации спинов электронов (они ответственны за появление магнитного момента), которые могут быть параллельными и антипараллельными, такую молекулу называют орто- и параводородом, соответственно.
Гремучий газ
По методу , 2—5 мл сточной воды выпаривают и сжигают в пламени гремучего газа в приборе Уикбольда. Из продуктов сгорания галогены удаляют с помощью раствора нитрата серебра, окислы азота — концентрированной серной кислотой. Образовавшуюся С02 поглощают в ячейке, наполненной раствором ВаС12 + ЫаОН + Н202 (pH = 11), и потенциометрически титруют с помощью автоматической бюретки, В качестве измерительного электрода служит платиновая проволока, электродом сравнения — каломельный полуэлемент. В течение 1 ч можно провести 12 определений.
Электрофлотацию можно осуществлять либо с применением диафрагмы, либо без нее. Во избежание перемешивания газов и образования гремучей смеси (2/3 водорода и 1/3 кислорода) предпочтение отдается диафрагменному варианту, тем более, что при этом можно уменьшить расстояние между электродами.
Сущность электрофлотационной очистки сточных вод заключается в переносе веществ из жидкости на ее поверхность с помощью пузырьков газа, образующегося при электролизе воды. При этом необходимо учитывать, что в процессе электролитического разложения воды образуется гремучий газ (смесь 2/3 водорода и 2/3 кислорода), который взрывоопасен в широком интервале концентраций водорода. По этой причине в промышленности применяют электролизеры с разделением газов.
Вода обладает свойствами катализатора. Без следов воды некоторые химические реакции протекали бы по-иному. Так, будучи обезвожена, серная кислота не реагирует со щелочными металлами, а те — с хлором, СО не горит в кислороде, а гремучий газ — не взрывает.
О том, что сами молнии способны разлагать водяные-пары на кислород и водород, в печати были сообщения. Например, В
Жвирблис обратил внимание на то, что раскаты грома не похожи на сухой треск электрического разряда молнии. Согласно его гипотезе, басовитые раскаты грома вызваны взрывом гремучего газа, образовавшегося в канале молнии
Этот раздел хочется закончить цитатой: «И самое главное, что часто новые-экспериментальные факты, какими бы частными на первый взгляд они не казались, могут открывать новый взгляд на окружающий мир».
Таким образом, микроорганизмов, использующих как источник энергии молекулярный водород и как единственный источник углекислоту, не так много, причем большинство растет в аэробных условиях и окисляет Нг с использованием 02. Такие микроорганизмы принято называть водородными бактериями или бактериями гремучего газа. Первые описания их были даны одновременно Лебедевым иКазерером в 1906 г., хотя биологическая природа процесса окисления молекулярного водорода в почве была установлена несколько раньше.
Пытаясь объяснить подмеченный природный эффект, ученые Индии выдвинули несколько гипотез. Одна из них утверждает, что при ветре, скорость которого приближается к 200 км/ч, происходит распад капель воды. Молекулы разлагаются на атомы водорода и кислорода. Атмосферные электрические разряды воспламеняют гремучий газ, и волны приобретают свою загадочную окраску» ы.
Анализ газовой смеси с применением объемно-манометрических (ОМ) газоанализаторов основан на изменении объема газовой пробы в результате извлечения из нее определяемого компонента или суммы нескольких компонентов. Это извлечение осуществляется при постоянных температуре и давлении с помощью химической реакции, селективной по отношению к определяемому компоненту, или путем физического воздействия на пробу, дающего тот же результат. Уменьшение объемной доли газовой смеси в процентах к.первоначальному соответствует содержанию извлеченного компонента. ОМ-Газоанали-заторы используют для, периодических наблюдений за содержанием в атмосфере и газовых выбросах С02, 802, МН3, 02, Н2, гремучей смеси (2Н2 +02) и некоторых других газов. Стационарные ОМ-газоанализа-торы имеют пределы измерений от 10° до 10 7 %.
Враг шахтеров
Иногда термин «гремучий газ» ошибочно используют в отношении метана. Способность этого углеводорода скапливаться в пустотах горных пород и при смешивании с воздухом становится взрывоопасной, она схожа со смесью настоящего газа, но на этом их схожесть и заканчивается. Формула газа в химии выглядит так: CH4.
Самая опасная концентрация в атмосфере метана составляет 9,5 %, но при разных условиях может варьировать от 5 до 16 %. При большей концентрации газ будет просто гореть. Спровоцировать взрыв может как искра, так и открытый огонь. Чтобы контролировать концентрацию метана в воздухе, шахтеры брали с собой канарейку, и знали, пока слышится песня маленького друга, работать можно спокойно. Но стоило птичке замолчать, это означало, что беда близко.
В начале 19 века певунов заменила шахтерская лампа Дэви, а сегодня контроль осуществляет автоматическая система, но и это не делает работу шахтеров полностью безопасной. Взрывы иногда случаются и сейчас. Вот такой он страшный — «рудничный газ».
История
Первое документированное использование искусственного охлаждения в 1756 году было осуществлено английским учёным Вильямом Калленом, Гаспар Монж первым получил жидкое состояние оксида серы в 1784 году, Майкл Фарадей первым получил сжиженный аммиак, американский изобретатель Оливер Эванс первым разработал холодильный компрессор в 1805 году, Яков Перкинс первым запатентовал охлаждающую машину в 1834 году и Джон Гори первым в США запатентовал кондиционер в 1851 году, Вернер Сименс предложил концепцию регенеративного охлаждения в 1857 году, Карл Линде запатентовал оборудование для получения жидкого воздуха с использованием каскадного «эффекта расширения Джоуля — Томсона» и регенеративного охлаждения в 1876 году. В 1885 году польский физик и химик Зигмунд Вро́блевский опубликовал критическую температуру водорода 33 K, критическое давление 13.3 атм. и точку кипения при 23 K. Впервые водород был сжижен Джеймсом Дьюаром в 1898 году с использованием регенеративного охлаждения и своего изобретения, сосуда Дьюара. Первый синтез устойчивого изомера жидкого водорода — — был осуществлен Полом Хартеком и Карлом Бонхеффером в 1929 году.
Механизм процесса горения водорода
Описанная в предыдущем пункте химическая реакция известна любому школьнику старших классов, однако она является очень грубым описанием того процесса, который происходит в действительности. Отметим, что до середины прошлого века человечество не знало, как происходит горение водорода в воздухе, а в 1956 году за ее изучение была присуждена Нобелевская премия по химии.
В действительности, если столкнуть молекулы O2 и H2, то никакой реакции не произойдет. Обе молекулы являются достаточно устойчивыми. Чтобы горение происходило, и образовывалась вода, необходимо существование свободных радикалов. В частности, атомов H, O и групп OH. Ниже приводится последовательность реакций, которые происходят в действительности при горении водорода:
- H + O2 => OH + O;
- OH + H2 => H2O + H;
- O + H2 = OH + H.
Что видно из этих реакций? При горении водорода образуется вода, да, верно, но происходит это только, когда группа из двух атомов OH встречается с молекулой H2. Кроме того, все реакции происходят с образованием свободных радикалов, это означает, что запускается процесс самоподдержания горения.
Таким образом, ключевой момент в запуске этой реакции заключается в образовании радикалов. Они появляются, если поднести к кислород-водородной смеси горящую спичку, либо если нагреть эту смесь выше определенной температуры.
Гремучий газ – польза или вред? Состав, формула, применение

В начале изучения такого предмета, как химия, самое интересное — это проводить опыты, а если эти опыты еще и сопровождаются небольшим эффектным взрывом, то восторг вообще сложно сдержать. При слове “взрыв” возникают разные ассоциации, и одна из них — гремучий газ. Какая у него формула, где он применяется и, конечно же, правила безопасности при работе с ним — главные вопросы статьи.
Применение
Где используется?
Интерес к такому альтернативному виду топлива, как водород проявляется все больше. Но первым разработчиком, который представил автомобиль, работающий на таком топливе, был концерн Toyota.
Однако его внедорожник FCHV так и остался выставочным экземпляром, серийно его выпускать не стали.
Интерес к водородным двигателям не пропал, поэтому многие производители продолжают вкладывать большие деньги на внедрение такого движка.
Температура горения смеси равна примерно 2235 °C, а продукты горения абсолютно безопасны для здоровья человека.
Нашла свое применение водородная горелка в ювелирном и зубопротезном деле, ей обрабатывают стеклянные изделия, пластины из дорогих металлов разной толщины и другое.
Враг шахтеров
Иногда термин “гремучий газ” ошибочно используют в отношении метана. Способность этого углеводорода скапливаться в пустотах горных пород и при смешивании с воздухом становится взрывоопасной, она схожа со смесью настоящего газа, но на этом их схожесть и заканчивается. Формула газа в химии выглядит так: CH4.
Самая опасная концентрация в атмосфере метана составляет 9,5 %, но при разных условиях может варьировать от 5 до 16 %. При большей концентрации газ будет просто гореть.
Спровоцировать взрыв может как искра, так и открытый огонь. Чтобы контролировать концентрацию метана в воздухе, шахтеры брали с собой канарейку, и знали, пока слышится песня маленького друга, работать можно спокойно.
Но стоило птичке замолчать, это означало, что беда близко.
В начале 19 века певунов заменила шахтерская лампа Дэви, а сегодня контроль осуществляет автоматическая система, но и это не делает работу шахтеров полностью безопасной. Взрывы иногда случаются и сейчас. Вот такой он страшный — “рудничный газ”.
Нажива для нечестных
Сколько счастья приносят воздушные шары, наполненные гелием. Мало есть детей, способных устоять перед разноцветным чудом. Да и праздники сейчас не обходятся без гелиевых шаров, которые тут же взмывают вверх, стоит на секунду отпустить нитку из рук.
Сегодня баллон гелия стоит приличных денег, а некоторые нерадивые продавцы решают сэкономить. Ведь заставить шарик летать может не только гелий, водород. Ацетилен тоже легче воздуха. Но так ли безопасна такая экономия для самих клиентов?
В последнее время все чаще слышатся новости о взрывах воздушных шаров:
- май, 2012 – Ереван;
- октябрь, 2017 – Кузбасс;
- октябрь, 2017 года – Кемерово.
Это лишь три известных случая, в одном из них, а именно на митинге в Ереване, шары были наполнены водородом, который мог выходить наружу и скапливаться в воздухе, смешиваясь с кислородом. А мы знаем, что такая смесь в определенной пропорции называется гремучим газом. В этой трагедии пострадали люди.
Нажива для нечестных
Сколько счастья приносят воздушные шары, наполненные гелием. Мало есть детей, способных устоять перед разноцветным чудом. Да и праздники сейчас не обходятся без гелиевых шаров, которые тут же взмывают вверх, стоит на секунду отпустить нитку из рук.
Сегодня баллон гелия стоит приличных денег, а некоторые нерадивые продавцы решают сэкономить. Ведь заставить шарик летать может не только гелий, водород. Ацетилен тоже легче воздуха. Но так ли безопасна такая экономия для самих клиентов?
В последнее время все чаще слышатся новости о взрывах воздушных шаров:
- май, 2012 — Ереван;
- октябрь, 2017 — Кузбасс;
- октябрь, 2017 года — Кемерово.

Это лишь три известных случая, в одном из них, а именно на митинге в Ереване, шары были наполнены водородом, который мог выходить наружу и скапливаться в воздухе, смешиваясь с кислородом. А мы знаем, что такая смесь в определенной пропорции называется гремучим газом. В этой трагедии пострадали люди.
Кинетическая схема горения водорода
Горение водорода формально выражается суммарной реакцией:
- 2H2+O2⟶2H2O{\displaystyle {\ce {2H2 + O2 -> 2H2O}}}.
Однако эта суммарная реакция не описывает разветвлённые цепные реакции, протекающие в смесях водорода с кислородом или воздухом. В реакциях участвуют восемь компонентов: H2, O2, H, O, OH, HO2, H2O, H2O2. Подробная кинетическая схема химических реакций между этими молекулами и атомами включает более 20 элементарных реакций с участием свободных радикалов в реагирующей смеси. При наличии в системе соединений азота или углерода число компонентов и элементарных реакций существенно увеличивается.
В силу того, что механизм горения водорода является одним из наиболее простых по сравнению с механизмами горения прочих газообразных топлив, таких, например, как синтез-газ или углеводородные топлива, а кинетические схемы горения углеводородных топлив включают в себя все компоненты и элементарные реакции из механизма горения водорода, он изучается чрезвычайно интенсивно многими группами исследователей. Однако, несмотря на более чем столетнюю историю исследований, этот механизм до сих пор изучен не полностью.
Критические явления при воспламенении
Полуостров самовоспламенения смеси H2 + O2. Цифрами 1, 2 и 3 помечены соответственно первый, второй и третий пределы воспламенения.
При комнатной температуре стехиометрическая смесь водорода и кислорода может храниться в закрытом сосуде неограниченно долго. Однако при повышении температуры сосуда выше некоторого критического значения, зависящего от давления, смесь воспламеняется и сгорает чрезвычайно быстро, со вспышкой или взрывом. Это явление нашло своё объяснение в теории цепных реакций, за которую Н. Н. Семёнов и Сирил Хиншелвуд были удостоены Нобелевской премии по химии 1956 года.
Кривая зависимости между критическими давлением и температурой, при которых происходит самовоспламенение смеси, имеет характерную Z-образную форму, как показано на рисунке. Нижняя, средняя и верхняя ветви этой кривой называются соответственно первым, вторым и третьим пределами воспламенения. Если рассматриваются только первые два предела, то кривая имеет форму полуострова, и традиционно этот рисунок называется полуостровом воспламенения.